Dichlordifluormethan
| Sicherheitshinweise | ||||||||
|---|---|---|---|---|---|---|---|---|
| ||||||||
| MAK |
| |||||||
| Treibhauspotential | 11547 (bezogen auf 100 Jahre) | |||||||
Dichlordifluormethan, auch R-12, Freon-12, ist ein ungiftiges, farbloses, unbrennbares, reaktionsträges und verflüssigbares Gas. Es ist schwerer als Luft, in hohen Konzentrationen wirkt es erstickend.
Es wurde als Kältemittel und Treibgas in Sprühdosen eingesetzt, bis es durch die FCKW-Halon-Verbots-Verordnung verboten wurde. Chemisch gehört es zur Gruppe der FCKW (Fluorchlorkohlenwasserstoffe) oder Freone. Es schädigt die Ozonschicht, falls es in die höhere Atmosphäre gelangt. R12 wurde als Bezugssubstanz für das Ozonabbaupotential (ODP) festgelegt und hat daher ein ODP von 1.
Bei sehr hohen Temperaturen kann es mit bestimmten Materialien mit großer Oberfläche (wie Aluminiumspänen, Kalium, Zink oder Magnesium) auch zur Explosion kommen.
| Strukturformel | |
|---|---|
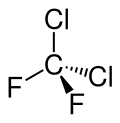 | |
| Keilstrichformel zur Verdeutlichung der Geometrie | |
| Allgemeines | |
| Name | Dichlordifluormethan |
| Andere Namen |
|
| Summenformel | CCl2F2 |
| Kurzbeschreibung | farbloses, unbrennbares Gas mit ätherischem Geruch |
| Externe Identifikatoren/Datenbanken | |
| CAS-Nummer | 75-71-8 |
| EG-Nummer | 200-893-9 |
| ECHA-InfoCard | 100.000.813 |
| PubChem | 6391 |
| ChemSpider | 6151 |
| Eigenschaften | |
| Molare Masse | 120,91 g/mol |
| Aggregatzustand | gasförmig |
| Dichte |
|
| Schmelzpunkt | −157,78 °C |
| Siedepunkt | −29,8 °C |
| Dampfdruck |
|
| Löslichkeit | schlecht in Wasser (300 mg/l) |
| Thermodynamische Eigenschaften | |
| ΔHf0 | −477,4 kJ/mol |
Gewinnung und Darstellung
Dichlordifluormethan kann durch Reaktion von Tetrachlormethan mit Fluorwasserstoff bei 490 °C und 70 atm gewonnen werden, wobei ein Gemisch von Trichlorfluormethan und Dichlordifluormethan in einem Verhältnis von 21:79 entsteht. Das Verhältnis kann durch Gegenwart von Antimon(III)-chlorid und Chlor noch verbessert werden.
Natriumhexafluorosilicat unter Druck bei 270 °C, Titan(IV)-fluorid, Chlortrifluori, Cobalt(III)-fluorid, Iodpentafluorid und Bromtrifluorid sind ebenfalls als Fluorierungsmittel für Tetrachlormethan geeignet.
Auch Antimon(III)-fluorid in Gegenwart von Antimon(V)-chlorid ist als Fluorierungsmittel geeignet.
Zu den Abbaureaktionen, die Dichlordifluormethan bilden, gehört die Chlorinolyse bei 550 °C von 1,1-Difluorethan, das durch Reaktion von Acetylen mit Fluorwasserstoff entsteht, oder Erhitzen von Silberchlordifluoracetat mit Chlor.
Herstellung und Verwendung
Die Herstellung und Verwendung von FCKWs, wie auch R-12, wurde 1987 im Montreal-Protokoll verboten, da diese Stoffe die schützende Ozonschicht zerstören. Lediglich Schwellenländern (z. B. auch China) wurde der Einsatz für den Eigenbedarf bis 2010 gestattet. Die Produktionsmengen von R-12 in China übertrafen den Eigenbedarf deutlich, und R-12 wurde auch in die EU importiert. Einfuhrverbote wurden dabei durch falsche Deklarationen umgangen.
Umwelteinfluss
-
 Konzentration in der Atmosphäre über die Zeit
Konzentration in der Atmosphäre über die Zeit -
 Konzentration (nmol/m³) im Meeresspiegel von R-12 (gemessen in den 1990er-Jahren)
Konzentration (nmol/m³) im Meeresspiegel von R-12 (gemessen in den 1990er-Jahren)


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 10.12. 2024

