
Fructose-1,6-bisphosphat
| Sicherheitshinweise | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
Fructose-1,6-bisphosphat oder Fructose-1,6-biphosphat, abgekürzt F-1,6-BP ist ein phosphorylierter Zucker, der im Stoffwechsel (Glykolyse) eine wichtige Rolle als Intermediat einnimmt. Die β-D-Form ist das in der Natur am häufigsten vorkommende Isomer. Es darf nicht mit Fructose-2,6-bisphosphat, einem sehr ähnlichen Metaboliten mit regulatorischer Aktivität, verwechselt werden.
| Strukturformel | ||
|---|---|---|
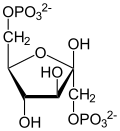
| ||
| β-D-Isomer | ||
| Allgemeines | ||
| Name | Fructose-1,6-bisphosphat | |
| Andere Namen |
| |
| Summenformel | C6H14O12P2 | |
| Kurzbeschreibung | farbloser Feststoff | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer |
| |
| EG-Nummer | 207-683-6 | |
| ECHA-InfoCard | ||
| PubChem | ||
| DrugBank | ||
| Eigenschaften | ||
| Molare Masse | 340,12 g/mol | |
| Aggregatzustand | fest | |
| Löslichkeit | 50 mg/ml Wasser | |
Geschichte
Eine der frühesten wissenschaftlichen Erwähnungen ist von 1933, die die Intermediate der Glykolyse untersuchte.[1] Zu diesem Zeitpunkt wurde die Verbindung als Fructosediphosphorsäure bezeichnet. Die Vorsilbe „bis“ wird heute verwendet, da sie korrekter ist. Sie gibt an, dass die beiden Phosphatgruppen nicht miteinander verbunden und an zwei verschiedenen Atomen lokalisiert sind.
Biologische Bedeutung
Fructose-1,6-bisphosphat ist ein wichtiges Intermediat beim Kohlenhydratstoffwechsel, z. B. beim Abbau von Glucose. So entsteht es im Zuge der Glykolyse aus Fructose-6-phosphat, was durch eine Phosphofructokinase unter Verbrauch von ATP phosphoryliert wird.0 Eine Aldolase spaltet in der Folgereaktion Fructose-1,6-bisphosphat in zwei C3-Bausteine: Glycerinaldehyd-3-phosphat und Dihydroxyacetonphosphat.
Auch beim Aufbau von Glucose (Gluconeogenese) wird F-1,6-BP gebildet. Dieses wird dann in Fructose-6-phosphat umgesetzt, was dann weiter zu Glucose-6-phosphat prozessiert wird.
Schließlich kann F-1,6-BP auch die Pyruvatkinase regulieren: Die Pyruvatkinasen der Leber, der Niere und in den Erythrozyten werden durch Fructose-1,6-bisphosphat allosterisch aktiviert.[2][3]
Einzelnachweise
- ↑ Embden, G. et al. (1933): Über die intermediären Vorgänge bei der Glykolyse in der Muskulatur In:
Klinische Wochenschrift 12(6), S. 213–215;
 doi:10.1007/BF01757728
doi:10.1007/BF01757728
- ↑ H. Robert Horton, Laurence A. Moran, K. Gray Scrimgeour, Marc D. Perry, J. David Rawn und Carsten Biele (Übersetzer): Biochemie. Pearson Studium; 4. aktualisierte Auflage 2008; ISBN 978-3-8273-7312-0; S. 469.
- ↑ Jeremy M. Berg, Lubert Stryer und John L. Tymoczko: Biochemie. Spektrum Akademischer Verlag; 6. Auflage 2007; ISBN 978-3-8274-1800-5; S. 520.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 01.11. 2025