Mannose
| Sicherheitshinweise | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
Mannose, in biochemischer Darstellung häufig mit Man abgekürzt, ist ein C2-Epimer der Glucose. Als D-Mannose ist sie eine natürliche Hexose und Baustein zahlreicher pflanzlicher Polysaccharide (Mannane). Im Organismus ist sie hauptsächlich Bestandteil von Membranen. Bezogen auf Saccharose hat eine 10%ige Lösung eine Süßkraft von 59 %.
Der Name ist abgeleitet von Mannit.
Wenn in diesem Text oder in der wissenschaftlichen Literatur „Mannose“ ohne weiteren Namenszusatz (Präfix) erwähnt wird, ist D-Mannose gemeint. Die (unnatürliche) L-Mannose ist synthetisch zugänglich und besitzt nur untergeordnete Bedeutung.
Eigenschaften
| Strukturformel | ||
|---|---|---|
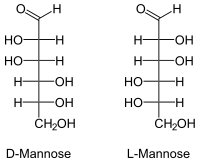
| ||
| Fischer-Projektion, offenkettige Darstellung | ||
| Allgemeines | ||
| Name | Mannose | |
| Andere Namen |
| |
| Summenformel | C6H12O6 | |
| Kurzbeschreibung | farb- und geruchloses, kristallines Pulver | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer |
|
|
| EG-Nummer | 208-474-2 | |
| ECHA-InfoCard | ||
| PubChem | ||
| Eigenschaften | ||
| Molare Masse | 180,16 g/mol | |
| Aggregatzustand | fest | |
| Dichte | 1,54 g/cm3 (D-Mannose) | |
| Schmelzpunkt |
| |
| Löslichkeit |
| |
Verhalten in wässriger Lösung
In wässriger Lösung kommt es teilweise zu einem intramolekularen Ringschluss, sodass sich ein Gleichgewicht zwischen der Aldehydform und den beiden Ringformen (Furanose-Form und Pyranose-Form) einstellt, wobei die Mannose dann fast ausschließlich in der Pyranoseform vorliegt:
D-Mannose – Schreibweisen Keilstrichformel Haworth-Schreibweise 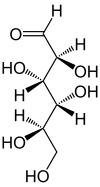
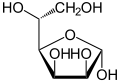
α-D-Mannofuranose
< 1 %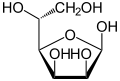
β-D-Mannofuranose
< 1 %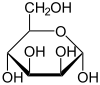
α-D-Mannopyranose
67 %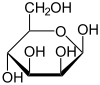
β-D-Mannopyranose
33 %Sesselkonformation 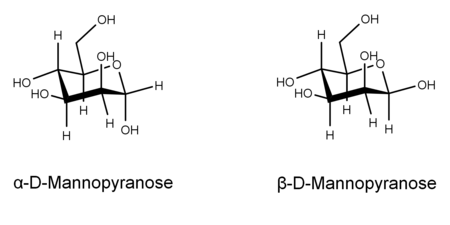
Mannose-Synthese
Durch die Glucose-6-phosphat-Isomerase wird Glucose-6-phosphat analog zur Glycolyse in Fructose-6-phosphat umgewandelt, welches wiederum mittels der Mannose-6-phosphat-Isomerase zu Mannose-6-phosphat isomerisiert wird. Eine weitere Umlagerung zu Mannose-1-phosphat wird durch das Enzym Phosphomannomutase katalysiert. Industriell wird Mannose aus Hölzern wie Birke und Buche, aber auch aus Mais hergestellt.
Abbau der Mannose
Gelangt freie Mannose in eine Zelle, so wird sie mittels des Enzyms Hexokinase zu Mannose-6-phosphat phosphoryliert, wodurch sie die Zelle nicht mehr verlassen kann, weil es kein passendes Transportprotein dafür in der Zellmembran gibt. Wenn sie nicht zum Aufbau neuer Glycoproteine benötigt wird, wird sie über die Mannose-Phosphat-Isomerase zu Fructose-6-phosphat umgewandelt, welches wiederum unter Energiegewinn der Glycolyse zugeführt werden kann.
GDP-Mannose
Eine Besonderheit der Mannose ist, dass ihre Aktivierung nicht über Uridintriphosphat (UTP), sondern über Guanosintriphosphat (GTP) erfolgt. Hierzu wird zuerst Mannose-6-phosphat zu Mannose-1-phosphat umgewandelt, welches dann weiter zur GDP-Mannose reagiert. Die Reaktionsfolge ist hierbei dieselbe wie bei der Reaktion von Glucose zu UDP-Glucose und bei der Glycogensynthese.
Toxizität für Insekten
Während Mannose für den Menschen nahezu ungiftig ist, besitzt diese für verschiedene Hautflügler wie Bienen (zu denen auch die Hummeln gehören) und die Gemeine Wespe Vespa vulgaris eine hohe Toxizität. Bei Bienen wurde eine letale Dosis von 0,4–0,5 mg ermittelt. Die Giftwirkung beruht auf der Ähnlichkeit der Mannose zu Glucose, die zu einer kompetitiven Hemmung verschiedener Enzyme führt.
Verwendung in der Medizin
Laut zweier Studien kann D-Mannose zur Prophylaxe von Blasenentzündungen eingesetzt werden. In anderen Publikationen wird diese Aussage jedoch angezweifelt.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 06.07. 2025