
Atomökonomie
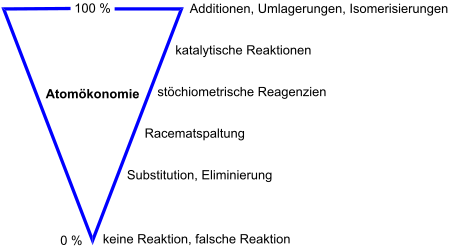
Die Atomökonomie (auch Atomeffizienz) ist der massemäßig prozentuale Anteil der in einer chemischen Reaktion von den Edukten in die Produkte überführten Atome. Der Begriff wurde 1991 von Barry M. Trost definiert.
Bedeutung und Anwendung
Die Atomökonomie
()
einer Reaktion ist definiert als die gesamte Molmasse des gewünschten Produkts
geteilt durch die Summe der gesamten Molmassen aller Edukte, ausgedrückt in Prozent. Sie kann dementsprechend folgendermaßen berechnet werden:
Für die Ermittlung der Atomökonomie mehrstufiger Synthesen ist eine praktikable Methode beschrieben worden. Für eine generische mehrstufige Synthese zur Herstellung vom Produkt
R
( ist der
Stöchiometriefaktor):
lässt sich die Atomökonomie wie folgt berechnen:
Der Massenerhaltungssatz besagt, dass die Gesamtmasse der Edukte mit der Gesamtmasse der Produkte identisch ist. Im obigen Beispiel entspricht also die Summe der Molmassen von A, B, C und D der Summe der Molmassen von R, X, Y und Z (Stöchiometriefaktor beachten). Da nur R das gewünschte Produkt ist, sind die Atome von X, Y und Z in Nebenprodukten verschwendet worden und dementsprechend Abfall. Die wirtschaftlichen und ökologischen Kosten der Entsorgung dieser Abfälle führen dazu, dass eine Reaktion (oder eine Synthese) mit geringer Atomökonomie „weniger grün“ ist. Eine Atomökonomie von 100 % bedeutet, dass alle Atome der Edukte im gewünschten Produkt zu finden sind (ganz plakativ: „kein Atom wird verschwendet“).
Die Atomökonomie zählt zu den Metriken (Kennwerten) der grünen Chemie und wird zur Beurteilung der Nachhaltigkeit eines chemischen Prozesses verwendet. In der chemischen Industrie spielt die Atomökonomie eine immer wichtigere Rolle. Moderne Synthesen werden so konzipiert, dass sie mit hoher Atomökonomie ablaufen, was zugleich meist das wirtschaftlichste Verfahren ist. Hohe Atomökonomie bedeutet, dass möglichst viele Atome der Edukte sich auch in dem gewünschten Produkt wiederfinden. Dadurch wird die Entsorgung unerwünschter, oft in stöchiometrischen Mengen entstehender Nebenprodukte minimiert oder gar gänzlich überflüssig.
Große Chemieunternehmen, z.B. die BASF AG (Verbundstandort), praktizieren seit Jahrzehnten erfolgreich in großem Stil angewandte Atomökonomie. Dabei wird nicht nur die maximale Effizienz eines Produktionsprozesses betrachtet, sondern die Effizienz eines komplexen Standortes als Einheit. Vermeintliche Abfallstoffe des Herstellungsprozesses A können wertvolle Edukte für den Produktionsprozess B darstellen.
Dieses Konzept wird auch unter energetischen Gesichtspunkten verfolgt. Die bei Kontiprozessen freiwerdende (exotherme) Reaktionsenergie kann in anderen Werksbereichen als Heizenergie genutzt werden.
Systematische Ansätze zu einer „nachhaltigen“ Chemie und der Einbeziehung weiterer Faktoren, die über die Atomökonomie hinausgehen, sind in der Literatur beschrieben. Dabei geht es um die Verwendung nachwachsender Rohstoffe, die Einbeziehung von Ökobilanzen, Sozialbilanzen, Produktlebenscyclen etc.
Die Suche nach neuen lichtinduzierten Mehrkomponentenreaktionen ist Gegenstand aktueller Forschung. Damit werden neue Methoden der organischen Synthesechemie aufgezeigt, deren Bedarf an nachhaltigen und atom- sowie energieeffizienten Reaktionen stetig dringlicher wird.
Beispiele
Atomökonomie verschiedener chemischer Reaktionen
- Eine völlig atomeffiziente Reaktion ist die [4+2]-Cycloaddition (Diels-Alder-Reaktion), bei der alle Atome der Edukte im Produkt wieder zu finden sind, ebenso die verwandten Cope- und Claisen-Umlagerungen.
- Die Fries-Verschiebung läuft atomeffizient ab, es fallen keine niedermolekularen Abfallstoffe an.
- Die Passerini-Reaktion ist eine atomeffiziente Mehrkomponentenreaktion ohne jegliche Bildung eines niedermolekularen Abfallstoffs.
- Die Addition von Brom an ein Alken unter Bildung eines Dibromalkans ist eine atomeffiziente Reaktion; hingegen ist die katalytische Bromierung von Benzol weniger atomeffizient, da neben Brombenzol ein Äquivalent Bromwasserstoff entsteht, vom Verbleib des Katalysators ganz abgesehen.
- Die Ugi-Reaktion ist eine atomeffiziente Mehrkomponentenreaktion, bei der lediglich ein Äquivalent Wasser abgespalten wird.
- Die Hydroformylierung ist eine atomeffiziente Reaktion, wenn die Regioselektivität hoch ist.
- Bei der industriellen Phenolsynthese nach dem Cumolhydroperoxid-Verfahren fällt Aceton als Kuppelprodukt in stöchiometrischer Menge an. Die Atomeffizienz ist mäßig, wenn nur das Phenol betrachtet wird und gut, wenn das anfallende Aceton als marktfähiges Nebenprodukt betrachtet wird. Im nächsten Abschnitt wird die Atomökonomie für diese Synthese berechnet.
- Eine wenig atomeffiziente Reaktion ist die Grignard-Reaktion, bei der erhebliche Salzabfälle entstehen.
- Die Herstellung von Thioamiden aus Amiden mit Lawessons Reagenz oder Phosphorpentasulfid ist wenig atomeffizient, die Abfallmengen sind in der Regel erheblich.
- Die Gabriel-Synthese ist ein Beispiel für eine Synthese mit ausgeprägt schlechter Atomökonomie; selbst bei hohen Ausbeuten entstehen wesentlich größere Mengen an Abfall als vom gewünschten Produkt (primäres Amin).
- Bei einer Racematspaltung kann bestenfalls eine Atomökonomie von 50 % erreicht werden, es sei denn, das ungewünschte Enantiomer racemisiert fortwährend oder es kann extern racemisiert und recycliert werden.
- Die Cannizzaro-Reaktion liefert bestenfalls mit 50 % Atomökonomie das gewünschte Reduktionsprodukt – einen Alkohol – der restliche Aldehyd wird zur Carbonsäure oxidiert.
Berechnung der Atomökonomie am Beispiel der industriellen Herstellung von Phenol
Die Chemikalie Phenol wird im industriellen Maßstab durch das Cumolhydroperoxid-Verfahren hergestellt, welches auch als Phenolsynthese nach Hock (Hock-Verfahren) bekannt ist:
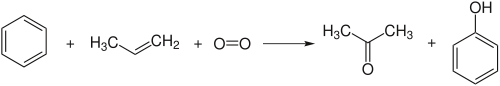
Um die Atomökonomie dieser Reaktion zu berechnen, müssen zunächst die Molmassen der Edukte (Benzol, Propen, Sauerstoff) und der Produkte (Aceton, Phenol) ermittelt werden. Diese sind in der nachstehenden Tabelle dargestellt:
| Molmasse [ |
78,11 | 42,08 | 31,98 | 58,08 | 94,11 |
Nun müssen die passenden Werte in die oben beschriebene Formel (aus dem Abschnitt „Bedeutung und Anwendung“) eingesetzt werden (es wird für diese Berechnung eine Ausbeute von 100 % angenommen):
Folglich besitzt die industrielle Phenolsynthese nach dem Cumolhydroperoxid-Verfahren eine Atomökonomie von rund 62 %. Daraus ist zu schließen, dass ca. 62 % der Atome der Edukte sich in dem gewünschten Produkt Phenol wiederfinden.
Grenzen der Atomökonomie
Die Atomökonomie () ist eine Kenngröße für die Beurteilung der Nachhaltigkeit eines chemischen Prozesses. Wie alle Werte, die komplexe Prozesse in bestimmten
Punkten beschreiben wollen besitzt der Wert der Atomökonomie auch gewisse Grenzen:
- Die Atomökonomie erfasst den im Prozess entstehenden Abfall nicht.
- Es werden nur die Reaktanten berücksichtigt, Lösungsmittel und Hilfsstoffe (Filterhilfen etc.) werden nicht erfasst.
- Der ökologische Impact des fertigen Produkts wird nicht beurteilt (also z.B. die Toxizität, die biologische Abbaubarkeit etc.).
Literatur
- Barry Trost: The atom economy – a search for synthetic efficiency, in: Science 1991, 254, S. 1471–1477,
doi:
 10.1126/science.1962206.
10.1126/science.1962206. - Manfred Schubert (Herausgeber): Abproduktarme und abproduktfreie Technologie, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig, 1. Auflage, 1987, ISBN 3-342-00093-7.
- Marco Eissen, Radoslaw Mazur, Heinz-Georg Quebbemann und Karl-Heinz Pennemann: Atom Economy and Yield of Synthesis Sequences,
Helvetica Chimica Acta 87 (2004) 524–535.
doi:
 10.1002/hlca.200490050.
10.1002/hlca.200490050.
- (a) Marco Eissen, Jürgen O. Metzger: Environmental Performance Metrics for Daily Use in Synthetic Chemistry, Chemistry a European Journal 8 (2002), 3580–3585; (b) Marco Eissen, Jürgen O. Metzger, Eberhard Schmidt, Uwe Schneidewind: 10 Jahre nach „Rio“ – Konzepte zum Beitrag der Chemie zu einer nachhaltigen Entwicklung, Angewandte Chemie 114 (2002) 402–425.
- Silvia Garbarino, Davide Ravelli, Stefano Protti und Andrea Basso: Photoinduzierte Mehrkomponentenreaktionen, Angewandte Chemie 128 (2016) S. 15702–15711.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 18.11. 2024