Diffusionskoeffizient
Der Diffusionskoeffizient ,
auch Diffusionskonstante oder Diffusivität
genannt, ist ein Transportkoeffizient
und dient in den Fickschen
Gesetzen zur Berechnung des thermisch
bedingten Transports eines Stoffes
aufgrund der zufälligen
Bewegung der Teilchen.
Dabei kann es sich um einzelne Atome
in einem Feststoff
oder um Teilchen in einem Gas
oder einer Flüssigkeit
handeln. Der Diffusionskoeffizient ist daher ein Maß für die Beweglichkeit
der Teilchen und lässt sich nach der Einstein-Smoluchowski-Gleichung
aus dem durchschnittlichen Quadrat der zurückgelegten Wegstrecke
pro Zeit
ermitteln:
(oder alternativ mittels der Green-Kubo-Relationen).
Die SI-Einheit
des Diffusionskoeffizienten ist daher .
Zur Angabe des Diffusionskoeffizienten gehört immer die Angabe, welcher Stoff in
welchem Stoff diffundiert,
sowie als wichtigste Einflussgröße die Temperatur.
In Gasen
| System | Temperatur in °C | Diffusionskoeffizient in m²/s |
|---|---|---|
| Luft – Sauerstoff | 0 | 1,76 × 10−5 |
| Luft – Kohlendioxid | 8,9 | 1,48 × 10−5 |
| 44,1 | 1,77 × 10−5 | |
| Wasserstoff – Stickstoff | 24,1 | 7,79 × 10−5 |
Diffusionskoeffizienten in Gasen sind stark abhängig von Temperatur und Druck. In erster Näherung gilt, dass eine Verdopplung des Druckes zur Halbierung des Diffusionskoeffizienten führt.
Der Diffusionskoeffizient folgt gemäß der Chapman-Enskog-Theorie folgender Gleichung für zwei gasförmige Stoffe (Indizes 1 und 2):
mit den physikalischen Größen
– Diffusionskoeffizient
- N – Avogadro-Konstante
- M1,2 – molare Massen der Stoffe
- kB – Boltzmann-Konstante
- T – Temperatur
- p – Druck
– (mittlerer) Kollisionsdurchmesser
– Kollisionsintegral, abhängig von Temperatur und Stoffen.
Für die Selbstdiffusion (d.h. für den Fall, dass nur eine Teilchensorte vorhanden ist) vereinfacht sich o.g. Zusammenhang zu:
mit
– mittlere thermische Geschwindigkeit der Teilchen
- l – mittlere freie Weglänge
- n – Teilchenzahldichte
- d – Teilchendurchmesser
- kB – Boltzmann-Konstante
- m – Molekülmasse
In Flüssigkeiten
| Stoff | Diffusionskoeffizient in m²/s |
|---|---|
| Sauerstoff | 2,1 × 10−9 |
| Schwefelsäure | 1,73 × 10−9 |
| Ethanol | 0,84 × 10−9 |
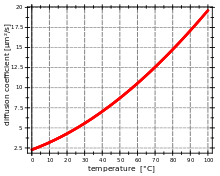
Diffusionskoeffizienten in Flüssigkeiten betragen in der Regel etwa ein Zehntausendstel von Diffusionskoeffizienten in Gasen. Sie werden beschrieben durch die Stokes-Einstein-Gleichung:
mit
- kB – Boltzmann-Konstante
- T – Temperatur
- η – dynamische Viskosität des Lösungsmittels
- R0 – hydrodynamischer Radius der diffundierenden Teilchen
Auf dieser Gleichung basieren viele empirische Korrelationen.
Da die Viskosität des Lösungsmittels eine Funktion der Temperatur ist, ist die Abhängigkeit des Diffusionskoeffizienten von der Temperatur nichtlinear.
In Feststoffen
| System | Temperatur in °C | Diffusionskoeffizient in m²/s |
|---|---|---|
| Wasserstoff in Eisen | 10 | 1,66 × 10−13 |
| 50 | 11,4 × 10−13 | |
| 100 | 124 × 10−13 | |
| Kohlenstoff in Eisen | 800 | 15 × 10−13 |
| 1100 | 450 × 10−13 | |
| Gold in Blei | 285 | 0,46 × 10−13 |
Diffusionskoeffizienten in Feststoffen sind in der Regel mehrere tausend Mal kleiner als Diffusionskoeffizienten in Flüssigkeiten.
Für die Diffusion in Festkörpern sind Sprünge zwischen verschiedenen Gitterplätzen erforderlich. Dabei müssen die Teilchen eine Energiebarriere E überwinden, was bei höherer Temperatur leichter möglich ist als bei niedrigerer. Dies wird beschrieben durch den Zusammenhang:
mit
- E – Energiebarriere
- R – allgemeine Gaskonstante
- T – Temperatur.
D0 lässt sich näherungsweise berechnen als:
mit
- α0 – Atomabstand
- N – Anteil der vakanten Gitterplätze
- ω – Sprungfrequenz
Allerdings empfiehlt es sich, insbesondere Diffusionskoeffizienten in Feststoffen experimentell zu bestimmen.
Effektiver Diffusionskoeffizient
Der effektive Diffusionskoeffizient
beschreibt Diffusion durch den Porenraum poröser Medien. Da
er nicht einzelne Poren, sondern den gesamten
Porenraum betrachtet, ist er eine makroskopische Größe:
mit
- εt – Porosität, die für den Transport zur Verfügung steht; sie entspricht der Gesamtporosität abzüglich Poren, die aufgrund ihrer Größe für die diffundierenden Teilchen nicht zugänglich sind, und abzüglich Sackgassen- und blinder Poren (Poren ohne Verbindung zum restlichen Porensystem)
- δ – Konstriktivität; sie beschreibt die Verlangsamung der Diffusion durch eine Erhöhung der Viskosität in engen Poren als Folge der größeren durchschnittlichen Nähe zur Porenwand und ist eine Funktion von Porendurchmesser und Größe der diffundierenden Teilchen.
- τ – Tortuosität („Gewundenheit“)
Scheinbarer Diffusionskoeffizient
Der scheinbare (apparente) Diffusionskoeffizient erweitert den effektiven Diffusionskoeffizienten um den Einfluss der Sorption.
Für lineare Sorption berechnet er sich zu:
mit
- Kd – linearer Sorptionskoeffizient
- ρ – Rohdichte
- ε – Porosität
Bei nichtlinearer Sorptionsisotherme ist der scheinbare Diffusionskoeffizient stets eine Funktion der Konzentration, was die Berechnung der Diffusion erheblich erschwert.
Siehe auch


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 29.03. 2022