
Diimin
| Sicherheitshinweise | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
Diimin (auch Diazen, Diimid, Azowasserstoff) ist eine anorganische Verbindung und bildet die Grundstruktur der organischen Azoverbindungen. Es ist bei Raumtemperatur instabil. Reines, festes, unterhalb −180 °C metastabiles Diimin hat eine leuchtend gelbe Farbe. Die Verbindung ist nicht unzersetzt sublimierbar, sehr lichtempfindlich und zerfällt unter Disproportionierung in Stickstoff und Hydrazin.
Gewinnung und Darstellung
Diimin lässt sich auf folgende Arten gewinnen:
- durch Dehydrierung von Hydrazin (z.B. durch Einwirkung von Mikrowellen)
- durch Umwandlung von Azoverbindungen (z.B. durch Protolyse von Azodicarbonat)
- durch Hydrierung von Stickstoff
| Strukturformel | |
|---|---|
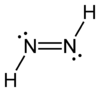 | |
| Allgemeines | |
| Name | Diimin |
| Andere Namen |
|
| Summenformel | H2N2 |
| Kurzbeschreibung | leuchtend gelber, metastabiler Feststoff unterhalb −180 °C |
| Externe Identifikatoren/Datenbanken | |
| CAS-Nummer | |
| PubChem | |
| Eigenschaften | |
| Molare Masse | 30,03 g·mol−1 |
Isomerie
Die Verbindung kommt in drei isomeren Formen vor, einer trans- (1), einer cis- (2) und einer iso-Form (3).
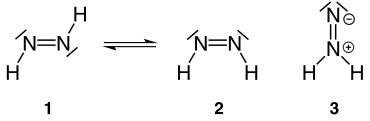
Geschichte
Die Substanz wurde 1972 von Nils Wiberg und Mitarbeitern zum ersten Mal isoliert. Hierbei wurde bei 60 °C eine Thermolyse von Natriumtosylhydrazid im Vakuum durchgeführt. Das Tosylhydrazid zerfiel dabei mit 80%iger Ausbeute in Diimin und Natriumtoluolsulfinat. Das Diimin wurde als leuchtend gelber Belag bei −196 °C an einem Kühlfinger abgeschieden. Der Nachweis im Gas erfolgte massenspektrometrisch. Die Herstellung gelang auch mit anderen Alkalimetalltosylhydraziden, allerdings in geringerer Ausbeute.
Diazene, Triazene, Tetrazene
Vom Diimin leiten sich formal die Diazene ab, bei denen die Wasserstoffatome des Diimins durch Alkyl- oder Arylgruppen ersetzt sind. Sie werden jedoch gewöhnlich als Azoverbindungen bezeichnet. Diazene können prinzipiell in einer (E)- oder einer (Z)-Form vorliegen, von denen die erstere die energetisch günstigere ist (siehe Cis-trans-Isomerie).
Formal lassen sich auch die Triazene und Tetrazene vom Diimin ableiten. Ein stabiles Derivat vom Triazen ist beispielsweise das Diazoaminobenzol. Ein Tetrazenderivat erhält man durch Oxidation von Phenylhydrazin in Form des gelben 1,1,4,4-Tetraphenyl-2-tetrazens.
Diazenyl-Rest
In der IUPAC-Nomenklatur kann eine Azobrücke als Diazenyl-Rest bezeichnet werden.
Anorganische Derivate
Ein Derivat des Diimins ist die Hyposalpetrige Säure (Diazendiol). Ein weiteres Derivat ist das Difluordiimin N2F2 (Difluordiazin). Ebenfalls gehören die Azosäuren (Diazendicarbonsäure) bzw. deren stabile Amide und Ester (beispielsweise Azodicarbonsäurediethylester) zu den Derivaten. Außerdem sind Azosilane, wie das trans-Bis(trimethyl-silyl)diimin, bekannt:
Diimin-Komplexe
Bekannt sind beispielsweise mehrkernige Carbonyl-Komplexe mit Chrom und Cyclopentadienyl-Komplexe mit Mangan, die durch Oxidation aus den entsprechenden Hydrazin-Komplexen hergestellt werden können. Im Unterschied zum reinen Diimin sind diese Diimin-Komplexe im festen Zustand relativ stabil, in Lösungen aber auch hoch reaktiv.
Diese beiden Komplexe waren die ersten Verbindungen, in denen Diimin fixiert und charakterisiert werden konnte.
Literatur
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 04.11. 2023