Batterie (Elektrotechnik)

Mit dem Begriff der elektrischen Batterie wird eine Zusammenschaltung mehrerer gleichartiger galvanischer Zellen bzw. Elemente bezeichnet, als welche zunächst, z. B. in der voltaschen Säule oder Zambonisäule, nur nicht wiederaufladbare sogenannte „Primärzellen“ bzw. „Primärelemente“ zur Verfügung standen. Mit der Entwicklung wirtschaftlich einsetzbarer wiederaufladbarer „Akkumulatoren“, auch „Sekundärzellen“ bzw. „Sekundärelemente“, z. B. des Bleiakkumulators um 1850 bis 1886, wurde die Benutzung des Begriffs „Batterie“ auch auf die Zusammenschaltung mehrerer solcher Zellen erweitert, z. B. in den späteren Starterbatterien von Kraftfahrzeugen oder Traktionsbatterien von U-Booten usw.
In letzter Zeit schließlich hat sich die Verwendung des Begriffs „Batterie“ auch auf einzelne Primär- oder Sekundärzellen ausgedehnt, wobei für letztere die Bezeichnung „Akkuzelle“ oder abgekürzt „Akku“ verwendet wird. Der geschilderte Wandel des Sprachgebrauchs wurde in der DIN-Norm 40729 Akkumulatoren; Galvanische Sekundärelemente; Grundbegriffe angesprochen, welche unter Batterie „immer mehrere verbundene Zellen“ verstanden hat, diese Begrifflichkeit sich bei der alltäglichen „Unterscheidung jedoch verwischt“ hat.
Unter Hinweis auf diese Begriffshistorie wird hier ausschließlich die Vielfalt „elektrischer Zellen“ beschrieben, die umgangssprachlich als „Batterien“ bezeichnet werden, wobei die Besprechung von „Primärzellen“ im Vordergrund steht – für eine nähere Besprechung von „Sekundärzellen“ siehe Hauptartikel Akkumulator.
Geschichte
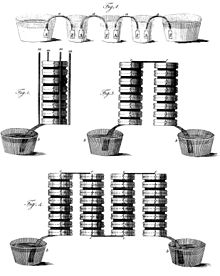
Im Jahr 1780 bemerkte der italienische Arzt Luigi Galvani, dass ein Froschbein, das in Kontakt mit Kupfer und Eisen kam, immer wieder zuckte, und hielt das für eine elektrische Wirkung. Das erste funktionierende galvanische Element und damit die erste Batterie wurde in Form der Voltaschen Säule im Jahr 1800 von Alessandro Volta erfunden. Es folgten in den Folgejahren konstruktive Verbesserungen wie die Trog-Batterie von William Cruickshank, welche den Nachteil des vertikalen Aufbaus der Voltaschen Säule vermied. Historisch wird zwischen Trockenbatterien, mit festem oder gelartigem Elektrolyt, und den heute nicht mehr gebräuchlichen Nassbatterien mit flüssigem Elektrolyt unterschieden.
Zu den historischen Nassbatterien, welche nur in bestimmter Lage betrieben werden können, zählen das Daniell-Element von John Frederic Daniell aus dem Jahre 1836 und die verschiedenen Variationen und Bauformen in Form der Gravity-Daniell-Elemente, das Chromsäure-Element von Johann Christian Poggendorff aus dem Jahre 1842, das Grove-Element von William Grove aus dem Jahre 1844, und das Leclanché-Element von Georges Leclanché aus dem Jahr 1866. Einsatzbereich dieser galvanischen Nasszellen war primär die Stromversorgung der drahtgebundenen Telegrafiestationen. Aus den Leclanché-Element gingen über mehrere Entwicklungsschritte die noch heute üblichen und lageunabhängigen Trockenbatterien hervor, erste Arbeiten dazu stammen von Carl Gassner, welcher die Trockenbatterie im Jahre 1887 patentierte. Im Jahr 1901 setzte Paul Schmidt in Berlin erstmals die Trockenbatterie bei Taschenlampen ein.
Als Batterien gedeutete antike Gefäßanordnungen wie die „Bagdad-Batterie“ hätten durch ein Zusammenspiel aus Kupfer, Eisen und Säure eine elektrische Spannung von circa 0,8 V produzieren können. Ob diese Gefäße zum damaligen Zeitpunkt vor etwa 2.000 Jahren als Batterien im heutigen Sinn verwendet wurde, ist umstritten und konnte nicht zweifelsfrei nachgewiesen werden.
Grundlagen
Eine elektrische Zelle ist ein elektrochemischer Energiespeicher und ein Energiewandler. Bei der Entladung wird gespeicherte chemische Energie durch die elektrochemische Redoxreaktion in elektrische Energie umgewandelt. Diese kann von einem vom Stromnetz unabhängigen elektrischen Verbraucher genutzt werden. Alternativ kann sie auch in einem vom Stromnetz abhängigen Verbraucher eingesetzt werden, um kurzzeitige Ausfälle im Stromversorgungsnetz zu überbrücken, und so eine unterbrechungsfreie Stromversorgung sicherstellen.
Primärzellen können nur einmal entladen und nicht wieder aufgeladen werden. In diesen Zellen sind die Reaktionen bei der Entladung teilweise umkehrbar, das führt jedoch nicht zur Wiederherstellung eines dem Neuzustand ähnlichen Energieinhalts. Dagegen sind die wiederaufladbaren Sekundärbatterien (Akkumulatoren) weitgehend in den Ladezustand ähnlich dem Neuzustand zu bringen, so dass eine mehrfache Umwandlung von chemischer in elektrische Energie und zurück möglich ist.
Die Elektrodenmaterialien legen die Nennspannung der Zelle fest, die Menge der Materialien die enthaltene Energie.
Wichtige Begriffe in Bezug auf die elektrischen Eigenschaften einer Batteriezelle sind:
- Kapazität
- Die in einer galvanischen Zelle gespeicherte elektrische Ladung wird als Kapazität bezeichnet, das ist nicht zu verwechseln mit der elektrischen Kapazität. Die Kapazität einer Batterie wird in der Dimension der elektrischen Ladung in Amperestunden (Einheitenzeichen: Ah), oder seltener in Amperesekunden (As) oder Coulomb (C; 1 As entspricht 1 C) angegeben.
- Leistung
- Die Leistung einer Batterie/Batteriezelle ist die Menge an elektrischer Energie, die pro Zeiteinheit entnommen werden kann. Sie wird in der Regel in Watt (W) angegeben. Sie ist das Produkt aus Entladestrom und Entladespannung oder auch der Quotient aus Energie und Zeit. Die Energie ist die Möglichkeit zur Arbeit; sie wird in Joule (J) angegeben.
- Energieinhalt
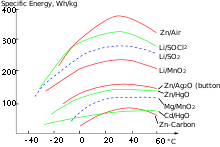
- Die in einer Batterie gespeicherte Energie (elektrische Arbeit) wird nicht immer angegeben, die Energie pro Masse oder pro Volumen ist jedoch eine typische Kenngröße von Batteriesystemen und oftmals in Datenblättern der Hersteller angeführt. Eine Einschätzung je nach Typ geben Diagramme vergleichender Energieangaben (siehe Diagramm). Die physikalische Einheit ist J/m³ oder J/kg.
- Selbstentladung
- Alle galvanischen Zellen unterliegen bei Lagerung einer Selbstentladung. Die Geschwindigkeit der Selbstentladung hängt unter anderem vom Batterietyp und der Temperatur ab. Je niedriger die Lagertemperatur, desto geringer ist die Selbstentladung.
Die schwächste Zelle bestimmt die Qualität einer Batterie. In Parallelschaltung kommt es durch Ausgleichsströme zu größeren Verlusten, wenn die Zelle mit geringerer Kapazität früher entladen ist. In Reihenschaltung bricht die Spannung unter Last eher zusammen, weil stärkere, noch geladene Zellen Strom durch schwächere, schon entladene Zellen treiben. Deren Innenwiderstand führt nach dem Ohmschen Gesetz zu einer Zellerwärmung, ohne dass die elektrische Energie nutzbar ist.
Einsatzbereiche
Je nach dem Einsatzgebiet gibt es folgende Begriffe und Zuordnungen:
- „Gerätebatterien“ dienen zur Stromversorgung kleiner, meist tragbarer Geräte, beispielsweise in Taschenlampen oder Mobiltelefonen. Meist bestehen sie aus mehreren Zellen in standardisierten Baugrößen sowohl als einmal verwendbare Primärzelle, als auch als wiederaufladbaren Akkumulator. Besonders kleine Ausführungen z. B. für Hörgeräte oder Quarzuhren werden als Knopfzellen bezeichnet.
- Starterbatterien für Kraftfahrzeuge, Traktionsbatterien bzw. zyklenfeste Speicherbatterien für Elektrofahrzeuge und stationäre, ortsfeste Anwendungen wie beispielsweise Unterbrechungsfreie Stromversorgungen. Diese Batterien sind immer Akkumulatoren.
Typvariationen
Aufgrund der vielfältigen Einsatzbereiche mit sehr unterschiedlichen Anforderungen bezüglich Spannung, Leistung und Kapazität gibt es heute Batterien in vielen Typen. Diese werden unterschieden beispielsweise
- nach chemischer Qualität in der zugrunde liegenden chemischen Redoxreaktion
- Zusammenschaltung von Zellen
- nach Zellengrößen
Handelsübliche Batterien und Zellen unterscheiden sich sowohl in den elektrischen Werten als auch in der geometrischen bzw. konstruktiven Bauform. Von den nachfolgend aufgeführten Bezeichnungen können mehrere zusammen einen Zelltyp beschreiben, z. B. „Alkali-Mangan-Zelle – LR 6/AM-3 – AA – Mignon“. Oft wird aber nur ein bestimmtes Merkmal gefordert, z. B. die Größe „AA“ für eine speziell darauf abgestimmte Taschenlampe.
Nach chemischer Zusammensetzung
Im experimentellen Bereich und zur Veranschaulichung des Funktionsprinzips werden recht exotische galvanische Zellen, wie zum Beispiel Zitronenzellen, eingesetzt.
- Siehe auch: Akkumulator (verschiedene Akku-Technologien) oder Superkondensator (Energiespeicher anderer Art).
Primärzellen
Als Primärzellen oder Primärelemente werden galvanische Zellen bezeichnet, die nach der Entladung nicht wieder neu aufgeladen werden können. Die verschiedenen Typen werden nach den eingesetzten Materialien bezeichnet (ausgenommen wiederaufladbare alkalische Zellen - diese werden trotzdem zu den Primärzellen gezählt):
- Standardbatterien (Basis: Zink-Mangan)
- Alkali-Mangan-Batterie; 1,5 V Nennspannung pro Zelle
- Zinkchlorid-Batterie; 1,5 V pro Zelle (nahezu vollständig durch Alkali-Mangan Batterie ersetzt)
- Zink-Kohle-Batterie; 1,5 V pro Zelle (in Europa nahezu vollständig durch Alkali-Mangan Batterie ersetzt, abgesehen von einigen größeren Bauformen wie z. B. Laternenbatterien)
- Spezialbatterien
- Zink-Luft-Batterie; 1,4 V pro Zelle
- Quecksilberoxid-Zink-Batterie; 1,35 V pro Zelle
- Silberoxid-Zink-Batterie; 1,55 V pro Zelle
- Nickel-Oxyhydroxid-Batterie; 1,7 V pro Zelle
- Lithiumbatterien; je nach Kathodenmaterial 1,8 V (FeS2) bis 3,7 V (SOCl2)
- Lithium-Eisensulfid-Batterie; 1,5 V pro Zelle
- Aluminium-Luft-Batterie; 1,2 V pro Zelle
- Biobatterie auf Basis Magnesium/NaCl/Eisen+Molybdän+Wolfram, im Körper zersetzlich
- Historische Batterien
- Edison-Lalande-Element; 0,75 V pro Element
Nach Baugröße / Bauform
Die gängigsten Batterien für den Verbrauchermarkt
Als Gerätebatterien werden häufig Batterien bezeichnet, die sehr verbreitet für die Energieversorgung von Elektrokleingeräten wie Uhren, Radios, Spielzeug, Taschenlampen u. Ä. und auch in fest installierten Geräten wie Rauchmeldern verwendet werden.
Gerätebatterien müssen kompakt, lageunabhängig einsetzbar, leicht und trotzdem mechanisch robust sein. Sie dürfen bei normaler Lagerung und Verwendung im Gerät weder auslaufen noch ausgasen. Sie sind in einer Vielzahl von Ausführungen auf der Basis von Zink-Kohle- oder Alkali-Mangan-Batterie im Handel erhältlich – Zink-Kohle-Batterien werden immer seltener angeboten und kaum noch hergestellt.
Es gibt sehr viele von der International Electrotechnical Commission (IEC) genormte Typen und einige Bezeichnungen vom ANSI sowie inoffizielle Namen, insbesondere für die neun gängigsten Kategorien:
Das R in der IEC-Bezeichnung steht immer für round, also Rundzellen, das F für flat, also eine flache Bauform. Nach der neuen IEC-60086-Bezeichnung (Methode 2, ab Oktober 1990) sind für die Typen die Maximalwerte der Abmessungen relevant. Gelegentlich geben Hersteller auch Istwerte an, diese sind in der Spalte Abmessungen in Klammern aufgeführt.
| Größenbezeichnung | Abmessungen | Nennspannung | Abbildung | ||
|---|---|---|---|---|---|
| IEC | ANSI | inoffiziell | |||
| R20 | 13 | D Mono |
Ø 34,2 mm × ca. 61,5 mm | 1,5 V bei R20 (Zink-Kohle)
1,5 V bei LR20 (Alkali-Mangan) |
 |
| R14 | 14 | C Baby |
Ø 26,2 mm × 50,0 mm
(Ø 25 mm × 49 mm) |
1,5 V bei R14 (Zink-Kohle)
1,5 V bei LR14 (Alkali-Mangan) |
 |
| R22C429 | − | Sub-C | Ø 22,2 mm × 42,9 mm
(Ø 22,2 mm × 42,5 mm) |
1,2 V bei KR22C429 (NiCd-Akku)
1,2 V bei HR22C429 (NiMH-Akku) |
 |
| R12 | − | B | Ø 21,5 mm × 60,0 mm | 1,5 V bei R12 (Zink-Kohle)
1,5 V bei LR12 (Alkali-Mangan) |
 |
| R23 | A | ca. Ø 17 mm × 50 mm
(Ø 16,5 mm × 48,5 mm) |
1,2 V als Akku |  | |
| R6 | 15 | AA Mignon |
Ø 14,5 mm × 50,5 mm
(Ø 14,5 mm × 49,5 mm) |
1,5 V bei R6 (Zink-Kohle)
1,5 V bei LR6 (Alkali-Mangan) |
 |
| R03 | 24 | AAA Micro |
Ø 10,5 mm × 44,5 mm | 1,5 V bei R03 (Zink-Kohle)
1,5 V bei LR03 (Alkali-Mangan) |
 |
| R8D425 | 25 | AAAA Mini |
Ø 8,3 mm × 42,5 mm | 1,5 V bei R8D425 (Zink-Kohle)
1,5 V bei LR8D425 (Alkali-Mangan) |
 |
| R1 | 910 | N L20 Lady |
Ø 12,0 mm × 30,2 mm | 1,5 V bei R1 (Zink-Kohle)
1,5 V bei LR1 (Alkali-Mangan) |
 |
| 2R10 | − | Duplex | ca. Ø 21,5 mm × 74 mm | 3,0 V bei 2R10 (Zink-Kohle) |  |
| 4R44 | - | 4AG13, L1325 | ca. Ø 13 mm × 25 mm | 6,0 V bei 4LR44 (Alkali-Mangan) |  |
| 8R932 | 1811A | 23A | Ø 10,3 mm × 28,5 mm | 12,0 V bei 8LR932 (Alkali-Mangan) |  |
| CR17345 | 5018LC | CR123A | Ø 17 mm × 34,5 mm | 3 V (Lithium) |  |
| 3R12 | − | Flachbatterie | ca. 65 mm × 61 mm × 21 mm | 4,5 V bei 3R12 (Zink-Kohle)
4,5 V bei 3LR12 (Alkali-Mangan) |
 |
| 4R25 | 908 915 |
Lantern Laternenbatterie |
ca. 114 mm × 66 mm × 66 mm | 6,0 V bei 4R25 (Zink-Kohle)
6,0 V bei 4LR25 (Alkali-Mangan) |
 |
| 6F22 | 1604 | 9-Volt-Block | ca. 48 mm × 26 mm × 17 mm | 9,0 V bei 6F22 (Zink-Kohle)
9,0 V bei 6LR61 (Alkali-Mangan) |
 |
| 15F20 | − | 15F20-Batterie | ca. 50 mm × 25 mm × 15 mm | 22,5 V bei 15F20 (Zink-Kohle) |  |
Rundzellen
Adapter und Kontaktierung
Nicht jeder Batterietyp ist in allen Ländern erhältlich. Deshalb gibt es zum Beispiel Flachbatterie-Adapter, die drei AA-Zellen zu je 1,5 V aufnehmen. Diese lassen sich in allen Geräten verwenden, in die auch eine Flachbatterie hineinpasst. Nützlich sind diese Adapter auch, weil es bis dato keine wiederaufladbaren Flachbatterien gibt.
Die Kontaktierung kleiner Batterien erfolgt mit Federkontakten, zuverlässigere Ausführungen für Lithiumbatterien sind vergoldet. Fest eingebaute Akkumulatoren sind mit Steckkontakten, Schraubanschlüssen, Polbolzen oder Lötfahnen versehen.
Konfektionierte wiederaufladbare Batterien, sogenannte Akkupacks, bestehen aus mehreren Zellen, die untereinander fest verbunden und oft mit einer Ummantelung oder einem Gehäuse versehen sind. Bei Starterbatterien sind die Zellen untereinander mit Bleistegen, bei Traktionsbatterien in der Regel mit Kupferverbindern kontaktiert.
Microsoft offerierte 2010 eine „InstaLoad“ genannte, rein mechanische Lösung eines Batteriefaches, die das Einlegen von Batterie-Einzelzellen in beliebiger Orientierung erlaubt. Die Kontakte sind dabei so gestaltet, dass keine Verpolung auftreten kann.
Entsorgung

des Typs 4LR44 nach IEC 60086.
Batterien und Akkumulatoren gehören nicht in den haushaltsüblichen Restmüllbehälter oder in die Umwelt, da sie umweltschädliche und zudem erneut nutzbare wertvolle Rohstoffe enthalten, die das Batterierecycling für entsprechende Unternehmen wirtschaftlich attraktiv machen. Auch ausgelaufene Batterien sollten mit Vorsicht behandelt werden, da sich teils ätzende Substanzen an den Kontakten befinden. Sie müssen ebenfalls einem Recycling zugeführt werden und gelten als Problemstoff.

In Deutschland regelt die Batterieverordnung die Rücknahme und Entsorgung von Batterien. Sie legt unter anderem fest, dass in Deutschland keine Batterien oder Zellen mit einem Quecksilbergehalt von mehr als 0,0005 Gewichtsprozent in den Verkehr gebracht werden dürfen. Bei Knopfzellen darf der Quecksilbergehalt nicht über 2,0 Gewichtsprozent liegen. Alkali-Mangan-Batterien enthalten seit Beginn der 1990er Jahre kein Quecksilber mehr. Davor wurde es zum Amalgamieren des Elektrodenmaterials Zink verwendet.
Kleine Batterien können in Deutschland in Einzelhandelsgeschäfte zurückgebracht werden, wenn diese auch Batterien verkaufen. Gesetzlich verpflichtend ist zwar nur die Rücknahme von Batterietypen, die der jeweilige Händler auch im Sortiment führt; da die Teilnahme am Rücknahmesystem für den Händler aber kostenlos ist, werden üblicherweise auch "fremde" Typen akzeptiert, da dem Händler dadurch keine Nachteile oder Kosten entstehen. Zu diesem Zweck müssen dort Sammelbehälter aufgestellt sein. Für Starterbatterien existiert in Deutschland ein Pfandsystem.
Je nach chemischer Zusammensetzung und Bauart einer Batterie ergeben sich verschieden lange Betriebsdauern und Leistungen. Anhand eines Rechenbeispiels wurde ermittelt, inwieweit die Menge des bei der Entsorgung von Batterien entstehenden Sondermülls von der Batterieart abhängt. Die Analyse ergab, dass die Verwendung moderner NiMH-Akkus nicht nur den geringsten Elektroschrott verursacht, sondern zudem auch das beste Preis-Leistungs-Verhältnis bietet. Die Nutzung von Einweg-Batterien auf Zink-Kohle-Basis hingegen führt zu einer extremen Verschwendung von Ressourcen.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 15.04. 2022