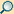Parasympathikus
Das vegetative Nervensystem
Rot: Nerven des Sympathikus, blau: Nerven des Parasympathikus
Der Parasympathikus (Parasympathicus) ist eine der drei Komponenten des vegetativen Nervensystems.
Er ist an der unwillkürlichen Steuerung der meisten
inneren Organe und des Blutkreislaufs beteiligt. Er wird auch als Ruhenerv oder Erholungsnerv bezeichnet, da er dem Stoffwechsel, der Erholung und dem Aufbau körpereigener Reserven dient (trophotrope Wirkung).
Vom Sympathikus werden vorwiegend gegenteilige Funktionen gesteuert, die bei besonderer Belastung
(Stress) eine Leistungssteigerung des Organismus bewirken
(ergotrope Wirkung). Diese beiden Hauptkomponenten des vegetativen Nervensystems
wirken als Gegenspieler einander ergänzend (synergistisch) und ermöglichen
dadurch eine äußerst feine Steuerung der Organe. Das im Darmtrakt vorhandene
enterische Nervensystem wird als dritte Komponente des vegetativen
Nervensystems bezeichnet.
Allgemeiner Aufbau
Die vegetativen Zentren des Parasympathikus liegen im Hirnstamm und im sakralen
Rückenmark (Pars sacralis,
Kreuzmark). Dabei innervieren Nerven aus dem Hirnstamm die inneren Augenmuskeln, die Tränen- und
Speicheldrüsen und die meisten inneren Organe des Körpers
(Nervus vagus). Nerven aus dem Kreuzmark hingegen beeinflussen den unteren Teil des
Dickdarms, die Harnblase
und die Genitalien. Der Übergang der beiden Innervationsgebiete beim
Dickdarm erfolgt am Cannon-Böhm-Punkt. Aufgrund der anatomischen Lage der
Wurzelzellen wird der Parasympathikus auch als kraniosakrales System
bezeichnet (von lat. Cranium = Schädel, Os sacrum = Kreuzbein), im Gegensatz zum thorakolumbalen System
des Sympathikus, dessen Wurzelzellen im Brust- (lat. Thorax) und Lendenteil (lat. Lumbus) des Rückenmarks liegen.
Ganglien
Ganglien stellen eine Anhäufung von Nervenzellkörpern
dar. Hier werden die vom Zentralnervensystem kommenden Nervenfasern
(präganglionäre Nerven, lat., „vor dem Ganglion“) auf Nervenfasern umgeschaltet, die zum jeweiligen Zielorgan ziehen (postganglionäre Nerven, lat.,
„nach dem Ganglion“). Die Ganglien liegen beim Parasympathikus – im Gegensatz zum Sympathikus – meist in der Nähe oder sogar innerhalb ihrer Zielorgane. Die Umschaltung
erfolgt an Schaltstellen üblicher Art (chemische Synapsen) durch Abgabe (Exozytose) von Signalmolekülen (Neurotransmittern) von Zelle A zum Andocken an Zelle B.
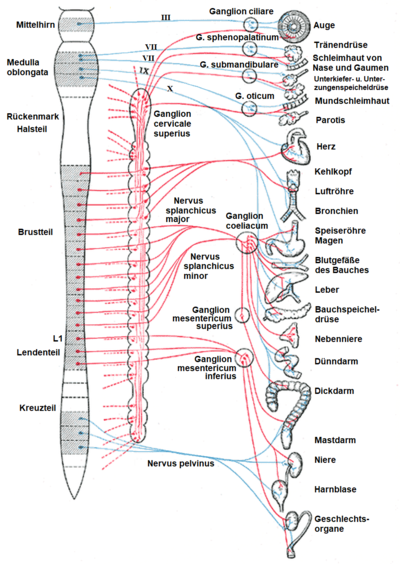
Neurotransmitter
Strukturformel von Acetylcholin
Die Überträgersubstanz (Neurotransmitter) des parasympathischen Nervensystems ist sowohl für die Schaltstelle in den Ganglien als auch am Zielorgan
Acetylcholin (ACh), ein Ester
der Essigsäure und des Aminoalkohols Cholin.
Die Synthese von Acetylcholin findet in der signalgebenden Nervenzelle (im präsynaptischen
Terminal) durch das Enzym Cholin-Acetyltransferase statt. Die Ausgangsstoffe sind Cholin und
Acetyl-Coenzym A. Nach seiner Freisetzung in den
synaptischen Spalt und Bindung an Rezeptoren der Zielzelle wird Acetylcholin durch
das Enzym Acetylcholinesterase zu den Endprodukten Cholin und Essigsäure
(beziehungsweise Acetat) abgebaut und damit deaktiviert.
Rezeptoren
Das parasympathische Nervensystem verfügt über zwei Typen von Acetylcholinrezeptoren,
also Rezeptoren, die auf Acetylcholin ansprechen. Nikotinische Rezeptoren (nAChR) reagieren außer auf Acetylcholin auch auf Nikotin. Muskarinische (mAChR) reagieren außer auf Acetylcholin auch auf Muskarin, ein Gift, das in größeren Mengen in verschiedenen Trichterlingen
und Risspilzen vorkommt (zuerst entdeckt im Fliegenpilz).
Nikotinische Rezeptoren
Schema eines nicotinischen ACh-Rezeptors
Die nikotinischen Rezeptoren lassen sich unterteilen nach ihrem örtlichen Vorkommen: NM-Rezeptoren befinden sich an innervierten Muskeln
(motorischen Endplatte). NN-Rezeptoren befinden sich in den
Ganglien. Die Rezeptoren der motorischen Endplatte und die der vegetativen Ganglien unterscheiden sich nur in ihrem Aufbau, in ihrer Funktion sind sie gleich.
Zu den Rezeptor-Komplexen gehören Kanäle in der Zellmembran, die nach Aktivierung des Rezeptors durchlässig für Kationen (positiv geladene Ionen wie
Na+ und Ca2+) werden. Deshalb
zählt man sie zur Gruppe der ionotropen Rezeptoren.
Binden Signalmoleküle an einen Rezeptor, so öffnet sich ein Ionenkanal und erzeugt damit einen Na+- und Ca2+-Einstrom (s.
Diffusion). Dieser verursacht eine lokale Veränderung der transmembranären elektrischen Spannung (exzitatorisches postsynaptisches Potential),
das heißt, er depolarisiert die Membran. Ist diese Depolarisation stark genug, so wird ein Aktionspotential ausgelöst und die Zielzelle erregt.
Die NM-Rezeptoren werden durch Tubocurarin gehemmt, die NN-Rezeptoren
durch Hexamethonium.
Muskarinische Rezeptoren
→
Hauptartikel: Muskarinischer Acetylcholinrezeptor
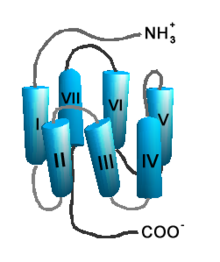
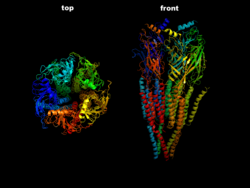
Dreidimensionale Struktur eines G-Protein-gekoppelten Rezeptors. Zu diesem Typ gehören die muskarinischen Rezeptoren.
Die muskarinischen Rezeptoren werden in die Subtypen M1 bis M5 unterschieden. M1 kommt in vegetativen Ganglien, M2 im Herzen
und M3 in glatter Muskulatur vor, hierbei vor allem im Verdauungstrakt. Die
Funktionen von M4 und M5 sind noch nicht gänzlich bekannt, sie kommen aber im Gehirn vor.
Die muskarinischen Rezeptoren gehören zur Gruppe der G-Protein-gekoppelten Rezeptoren. Nach der Bindung von Acetylcholin werden weitere Moleküle (so genannte
Second Messenger) freigesetzt, die dann Veränderungen an der Zelle auslösen. Deshalb gehören sie zur Gruppe der
metabotropen Rezeptoren.
Bei den M1-, M3- und M5-Rezeptoren löst die Bindung von Acetylcholin die Aktivierung der
Phospholipase Cβ (PLCβ) durch ein Gq-Protein aus. Die
Phospholipase spalteten Phosphatidylinositol-4,5-bisphosphat (PIP2, ein Phospholipid) in Inositoltrisphosphat
(IP3) und Diacylglycerol (DAG). Während DAG in der Zellmembran verbleibt,
bewirkt IP3 eine Freisetzung von Calcium aus dem endoplasmatischen
Retikulum (ER). Dieses löst entweder ein verzögertes elektrisches Signal (EPSP)
oder eine Kontraktion von glatter Muskulatur im Fall der M3-Rezeptoren aus.
M2- und M4-Rezeptoren hingegen aktivieren ein Gi-Protein (i für inhibitorisch, hemmend). Dieses öffnet im
Sinus- und AV-Knoten des Herzens bestimmte K+-Kanäle (IKACh). Dies hat eine negativ chronotrope (pulssenkende) und dromotrope (Erhöhung der Zeit, die für die
Reizweiterleitung benötigt wird) Wirkung. Zusätzlich wird das Enzym
Adenylylcyclase gehemmt, mit der Wirkung des Rückgang der intrazellulären
cAMP-Konzentration. Dieser Rückgang senkt den Calcium-Einstrom,
was eine Reduzierung der Kontraktionsfähigkeit des Herzens zur Folge hat (negativer inotroper Effekt).
Gehemmt werden muskarinische Rezeptoren unter anderem durch Atropin, ein Gift, das auch in der
Tollkirsche vorkommt.
Anatomische Struktur
Hirnstamm
Die parasympathischen Kerngebiete (Nuclei) des Hirnstamms liegen in den
Nuclei des Nervus oculomotorius (Hirnnerv III),
Nervus facialis (VII),
Nervus glossopharyngeus (IX) und
Nervus vagus (X).
Nervus oculomotorius
| Zielorgan |
Wirkung
|
| Musculus sphincter pupillae |
Kontraktion
|
| Ziliarmuskel |
Kontraktion
|
Die präganglionären Fasern des parasympathischen Anteils des Nervus oculomotorius (Augenbewegernerv) entspringen dem Nucleus accessorius nervi oculomotorii
(zusätzlicher Kern des Augenbewegernervs, Edinger-Westphal-Kern) und ziehen
zum Ganglion ciliare. Dort schalten sie um auf
Neuronen der Nervi ciliares breves. Diese verlaufen zum Musculus sphincter pupillae („Pupillenverenger“), wo sie eine Verengung
(Miosis) der Pupillen verursachen, und zum Ziliarmuskel, der die Brechkraft der Augenlinse (Akkommodation) beeinflusst.
Nervus facialis
| Zielorgan |
Wirkung
|
| Tränendrüsen |
Aktivierung
|
| Glandula submandibularis |
Aktivierung
|
Der parasympathische Anteil des Nervus facialis (Gesichtsnerv) entspringt im
Nucleus salivatorius superior (oberer Speichelkern), in der Medulla oblongata
(Nachhirn). Ein Teil dieser Fasern, der Nervus petrosus major (großer Paukennerv),
verläuft zum Ganglion pterygopalatinum (Flügelgaumenganglion), wo
er auf Neuronen umgeschaltet wird, deren Fasern im Nervus lacrimalis
(Tränennerv) zur Tränendrüse verlaufen, die dadurch zur Tränenproduktion angeregt werden.
Ein weiterer Teil des Nervus facialis, die Chorda tympani (Paukensaite), verläuft zum
Ganglion submandibulare (Unterkieferganglion), wo es auf Neuronen
umgeschaltet wird, die die Speicheldrüsen am
Unterkiefer, die Glandula submandibularis (Unterkieferdrüse) und die Glandula sublingualis (Unterzungendrüse), innervieren. Sie lösen dort eine Gefäßerweiterung der versorgenden Arterien und eine gesteigerte
Proteinproduktion aus und machen den Speichel damit wässrig.
Nervus glossopharyngeus
| Zielorgan |
Wirkung
|
| Parotis |
Aktivierung
|
Die präganglionären parasympathischen Fasern des Nervus glossopharyngeus
(von griech. glossa=Zunge, pharynx=Rachen) entspringen dem Nucleus salivatorius inferior (unterer Speichelkern) in der Medulla oblongata. Seine Fasern
verlaufen, teilweise im Nervus petrosus minor
(kleiner Paukennerv) zum Ganglion oticum (Ohrganglion), wo sie auf Neuronen umgeschaltet
werden, die im Nervus auriculotemporalis („Ohr-Schläfen-Nerv“) zur
Glandula parotidea (Ohrspeicheldrüse) verlaufen und diese zur
Speichelabsonderung anregen.
Nervus vagus
Die präganglionären parasympathischen Fasern des Nervus vagus (von lat. vagari –
„umherschweifen“) entspringen dem Nucleus dorsalis nervi vagi (rückwärtiger Kern des Vagusnervs) in der Medulla oblongata. Der Nervus vagus verlässt den Schädel
durch das Foramen jugulare und verläuft dann zusammen mit der
Arteria carotis communis (Halsschlagader) und der
Vena jugularis interna (innere Drosselvene) im Hals in Richtung Körper.
Dort innerviert er das Herz, die Bronchien, den Verdauungstrakt und den
Harnleiter.
Kreuzmark
Der Kreuzteil des Parasympathikus entspringt dem Nucleus intermediolateralis (äußerer Zwischenkern) und Nucleus intermediomedialis (innerer Zwischenkern) in den
Rückenmarkssegmenten S2 bis S4. Sie verlaufen im
Nervus pudendus (Schamnerv) und gehen von diesem als Nervi pelvici (Beckennerven)
in den Plexus hypogastricus inferior (unteres Untermagengeflecht)
ein. Die Umschaltung auf weitere Neuronen erfolgt entweder hier oder in kleinen Ganglien der innervierten Organe.
Zielorgane sind der Dickdarm unterhalb des Cannon-Böhm-Punktes, die
Harnblase und die Genitalien.
Unterer Dickdarm
| Dickdarm
|
| Aktiviert die Sekretion
|
| Aktiviert den Tonus
|
| Entspannt den (inneren) Schließmuskel
|
Der Parasympathikus hat eine anregende Wirkung auf den Dickdarm, genau wie auf den restlichen Verdauungstrakt. Die Drüsen werden zur Sekretion angeregt, der Tonus der glatten
Muskulatur wird erhöht und die Schließmuskel werden entspannt.
Außerdem ist der Parasympathikus an einem Reflex beim Stuhlgang
(Defäkation) beteiligt. Werden
freie Nervenendigungen im Rektum durch Dehnung stimuliert, so werden Signale in die Kreuzsegmente des Rückenmarks gesendet. Diese lösen dort die Aussendung von Signalen zum
Colon descendens (absteigenden Grimmdarm), Colon sigmoideum und Mastdarm aus. Diese laufen in parasympathischen
Fasern des Nervus pelvicus,
erhöhen die Anzahl und Stärke der peristaltischen Wellen der glatten Muskulatur in der Darmwand
und entspannen den inneren Schließmuskel des Anus. Im Gegensatz zum inneren Schließmuskel, der aus glatter
Muskulatur besteht, ist der äußere Schließmuskel ein Skelettmuskel und damit unter
willkürlicher Kontrolle.
Harnblase
| Harnblase
|
| Kontraktion des Detrusor
|
| Entspannung des Sphinkter
|
Das Harnlassen (die Miktion) unterliegt der vegetativen (autonomen) Steuerung
durch den Parasympathikus. Er aktiviert die glatte Muskulatur in der Wand der Harnblase (Musculus detrusor) und damit ein Zusammenpressen der gesamten Blase.
Zusätzlich wird der innere Schließmuskel (Sphinkter) der Blase durch den
Parasympathikus entspannt.
Genitalien
In den Genitalien bewirkt der Parasympathikus eine Erweiterung von Blutgefäßen (Vasodilatation),
eine der notwendigen Voraussetzungen der Erektion.
Wirkung des Nervus vagus auf die inneren Organe
Die parasympathische Innervation der inneren Organe erfolgt durch den Nervus vagus. Die
betroffenen Organe sind Herz, Bronchien, Magen, Darm (bis auf den unteren Dickdarm, der vom Kreuzmark innerviert wird),
Gallenblase, Leber,
Bauchspeicheldrüse (Pankreas) und die Harnleiter.
Herz
| Herz
|
Erregungsleitung langsamer
(negativ dromotrop)
|
Erregbarkeit reduziert
(negativ bathmotrop)
|
Frequenz reduziert
(negativ chronotrop)
|
Am Herz bewirkt der Parasympathikus eine Verlangsamung des Pulses (negative
Chronotropie) und der Erregbarkeit (negative
Bathmotropie). Außerdem verlangsamt er die Erregungsleitung vom
Sinusknoten zum AV-Knoten und im AV-Knoten selbst (negative Dromotropie).
Die Versorgungsgebiete des rechten und linken Nervus vagus überlappen sich am Herzen, wobei der rechte vorwiegend den Sinusknoten innerviert und dort die Pulsfrequenz
beeinflusst, der linke hingegen hauptsächlich den AV-Knoten und damit die Erregungsleitung.[1]
Die cholinergen Rezeptoren im Herzen sind vom Typ M2. Sie aktivieren ein Gi-Protein (i für inhibitorisch, hemmend). Im Sinus- und AV-Knoten
öffnet es bestimmte K+-Kanäle (IKACh). Durch den bewirkten Kaliumausstrom wird die
Zelle hyperpolarisiert, das heißt, ihr
Membranpotential wird negativer. Dies erschwert die Auslösung eines
Aktionspotentials, das zur Muskelkontraktion führt.
In den Herzmuskelzellen werden die langsamen Natriumkanäle, sogenannte „Funny-Channels“ (cAMP-abhängig),
teilweise inaktiviert und so verzögert sich die spontane Depolarisation der Schrittmacherzellen (Frequenzabnahme, negativ chronotrop).
Bronchien
| Bronchien
|
| Aktiviert die Sekretion
|
| Kontraktion der glatten Muskulatur
|
In den Bronchien löst der Parasympathikus Bronchokonstriktion (Verengung der
Bronchien) und eine erhöhte Schleimsekretion durch Stimulation der M3-Rezeptoren aus.
In der glatten Muskulatur der Bronchien löst der durch IP3 ausgelöste Calciumeinstrom eine Kontraktion aus, dies führt zur Verengung der Bronchien.
Die erhöhte Sekretion der schleimproduzierenden Drüsen wird durch eine erhöhte Blutzufuhr ausgelöst. Die erhöhte Blutzufuhr wird durch die Freisetzung von
Stickstoffmonoxid (NO) und die dadurch bewirkte Gefäßerweiterung (Vasodilatation)
verursacht.
Verdauungstrakt
| Verdauungstrakt
|
| Aktiviert die Sekretion
|
| Aktiviert den Tonus
|
| Entspannt die Schließmuskeln
|
Der Verdauungstrakt besitzt ein eigenes Nervensystem, das enterische Nervensystem. Dessen Steuerungsarbeit wird durch das parasympathische Nervensystem nur modulierend beeinflusst.
Letzteres fördert dabei generell die Verdauung durch Steigerung der Fördertätigkeit
(Peristaltik) und Abgabe (Sekretion) von Verdauungsenzymen. Im Magen und Darm wird zudem
der Tonus (Spannungszustand) der glatten Muskulatur erhöht und die Schließmuskeln
(Sphinkter) durch Stickstoffmonoxid (NO) entspannt.
Die Tonuserhöhung und die erhöhte Sekretion der Drüsen basiert auf den gleichen Mechanismen wie in der Lunge.
Leber, Gallenblase und Pankreas
| Leber, Gallenblase, Pankreas
|
| Leber: Glykogen-Synthese
|
| Gallenblase: Kontraktion
|
| Pankreas: Exokrine Sekretion
|
In der Leber regt der Parasympathikus die Glykogenbildung an.
In der Gallenblase löst er durch die Kontraktion der glatten Muskulatur in der Organwand
die Abgabe von Galle aus.
Die exokrinen Absonderungen (Sekretion) der Bauchspeicheldrüse werden durch die Erhöhung der Durchblutung angeregt. Dies bewirkt die Sekretion der eiweißspaltenden Verdauungsenzyme
(Trypsin, Chymotrypsin, Elastase,
Carboxylpeptidase).
Harnleiter
| Harnleiter
|
| Kontraktion der glatten Muskulatur
|
Die glatte Muskulatur im Harnleiter wird durch die Innervation des Nervus vagus kontrahiert.
Klinische Bedeutung
Die Wirkung des Parasympathikus kann durch Medikamente beeinflusst werden.
Die angestrebte Wirkung orientiert sich jeweils an der durch den Parasympathikus modulierten Organwirkung und deren Veränderung bei Anwendung von Medikamenten. Man
unterscheidet Parasympatholytika, welche die Wirkung des
Parasympathikus hemmen und Parasympathomimetika, welche die Wirkung anregen.
Parasympatholytika
Parasympatholytische Substanzen (Anticholinergika) wie
Atropin wirken über eine kompetitive Hemmung des Acetylcholins. Bei Anwendung überwiegt aufgrund der Hemmung des Parasympathikus dann der Einfluss des Sympathikus.
Anwendungsgebiete sind z. B. die Pupillenerweiterung (Mydriasis) für therapeutische Maßnahmen,
die Therapie von Spasmen des Magen-Darm-Traktes, der Harnwege sowie der Muskulatur
der Atemwege (Bronchospasmus). Auch akute Bradykardien, d. h. der starke Abfall der Herzfrequenz, können durch Parasympatholytika behandelt werden.
Parasympathomimetika
Es gibt direkt und indirekt wirkende Parasympathomimetika.
Erstere (wie Pilocarpin) wirken ähnlich dem Acetylcholin. Bei den indirekten Parasympathomimetika
wie Physostigmin handelt es sich um reversible oder irreversible
Cholinesterasehemmer, welche den Abbau des Acetylcholins durch die
Cholinesterase hemmen und so eine längere Transmitterwirkung bedingen.
Anwendungsgebiete der Parasympathomimetika umfassen z. B. die Therapie von Glaukomen.
Literatur
- Eric Kandel, James Schwartz, Thomas Jessell (Hrsg.): Neurowissenschaften. Spektrum, Springer 1995, ISBN 3-86025-391-3.
- Johannes W. Rohen: Funktionelle Neuroanatomie. Lehrbuch und Atlas. Schattauer Verlag 2001, ISBN 3-7945-2128-5.
- Robert F. Schmidt, Hans-Georg Schaible (Hrsg.): Neuro- und Sinnesphysiologie, 5. Auflage. Springer, Berlin 2006, ISBN 3-540-25700-4.
- Robert F. Schmidt, Florian Lang, Gerhard Thews: Physiologie des Menschen. Mit Pathophysiologie. Springer, Berlin 2004, ISBN 3-540-21882-3.
Einzelnachweise
- ↑ M Rubart, DP Zipes: Anatomy of the Cardiac Conduction System. In: DP Zipes et al. (Hrsg.):
Braunwald’s Heart Disease: A Textbook of Cardiovascular Medicine. 7. Auflage. W.B. Saunders Company, Philadelphia 2004, ISBN 1-4160-0014-3, S. 653–659.
Basierend auf einem Artikel in:  Wikipedia.de
Seite zurück
Wikipedia.de
Seite zurück
© biancahoegel.de
Datum der letzten Änderung: Jena, den: 13.02. 2026