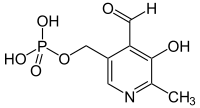
Pyridoxalphosphat
| Sicherheitshinweise | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
Pyridoxalphosphat (kurz PLP oder auch PALP, P5P) ist einer der wichtigsten Cofaktoren im tierischen Organismus. Unter physiologischen Bedingungen liegt die Phosphatgruppe deprotoniert und zweifach negativ geladen vor. PLP ist an verschiedenen Reaktionen der Aminosäuren beteiligt:
sowie am Abbau des Glykogens.
Pyridoxalphosphat ist die aktive Form des Pyridoxins (Vitamin B6).
| Strukturformel | |
|---|---|
 | |
| Allgemeines | |
| Name | Pyridoxalphosphat |
| Andere Namen | |
| Summenformel | C8H10NO6P |
| Kurzbeschreibung | hellgelber Feststoff |
| Externe Identifikatoren/Datenbanken | |
| CAS-Nummer |
|
| EG-Nummer | 200-208-3 |
| ECHA-InfoCard | 100.000.190 |
| PubChem | 1051 |
| ChemSpider | 1022 |
| DrugBank | DB00114 |
| Eigenschaften | |
| Molare Masse | 247,14 g/mol |
| Aggregatzustand | fest |
| Schmelzpunkt | 140–143 °C |
Rolle bei der Transaminierung
Bei der Transaminierung wird eine Aminogruppe einer Aminosäure a auf eine Ketosäure b übertragen. Die Aminogruppe wird praktisch ausgetauscht; es entsteht aus der Ketosäure eine Aminosäure und die „Spender-Aminosäure“ bleibt als Ketosäure zurück.
Pyridoxalphosphat übernimmt dabei die Rolle des „Boten“, transportiert also die Aminogruppe von a nach b. Dazu wird die Aminogruppe vorübergehend an PLP gebunden, das in dieser Form Pyridoxaminphosphat heißt. Es liegt dabei in einem Komplex, gebunden an das spezifische Enzym, vor.
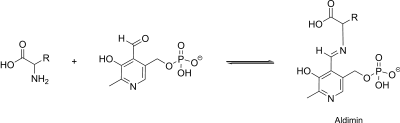
Während der Interaktion mit der Aminosäure bzw. mit der Ketosäure bildet PLP mit seinem Reaktionspartner eine sogenannte Schiff'sche Base (Aldimin). Sie wird durch eine positiv geladene Gruppe des Enzyms stabilisiert. Nun kommt es durch die N-Gruppe des Pyridins zur intramolekularen Ladungsverschiebung und zur Ketiminformation. Hierbei wird eine Bindung je nach Operation am α-C-Atom der Aminosäure gelockert.
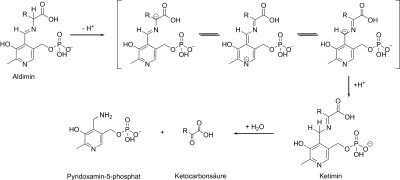
Es kommen Transaminierungen und α- bzw. β-Eliminierungen vor.
Rolle bei der Eliminierung
Hier bildet Pyridoxalphosphat zunächst auch eine Schiffsche Base mit der Aminogruppe einer Aminosäure wie z.B. Cystein. Eine Ladungsverschiebung führt hier zu einem Lösen der Bindung zwischen dem α-C-Atom und Wasserstoff. Die SH-Gruppe am α-C-Atom wird zusammen mit diesem Proton als Schwefelwasserstoff abgespalten. Es kommt nun reaktiv zur Hydrolyse der Schiffschen Base zwischen Aminosäure und Pyridoxalphosphat. Die dabei abgespaltene Aminopropensäure lagert sich zur Iminopropansäure um und reagiert unter Freisetzung von Ammoniak zur Brenztraubensäure.
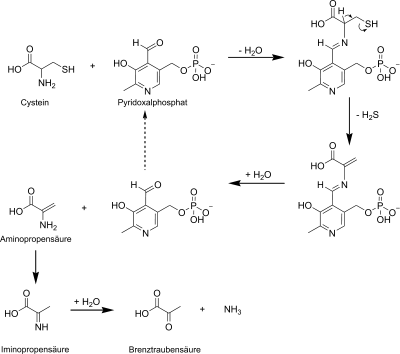
Solche Eliminierungen finden für Cystein, Threonin und Serin statt. Ferner gibt es noch β,γ-Eliminierungen in Einzellern, dort an Homoserin und Homocystein.
Siehe auch


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 22.07. 2025