Eisen(II)-disulfid
| Sicherheitshinweise | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
Eisen(II)-disulfid ist das Disulfid des zweiwertigen Eisens mit der Formel FeS2.
Vorkommen
Natürlich kommt Eisen(II)-disulfid mineralisch als Pyrit oder als Markasit vor.
Gewinnung und Darstellung
Eisen(II)-disulfid kann durch Erhitzen von Eisen(II)-sulfid mit Schwefel hergestellt werden:
Ebenso entsteht Eisen(II)-disulfid beim Überleiten von Schwefelwasserstoff H2S über Eisen(III)-oxid bei Rotglut:.
| Kristallstruktur | |
|---|---|
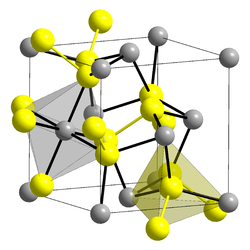 | |
| __ Fe2+ __ __ S22− | |
| Allgemeines | |
| Name | Eisen(II)-disulfid |
| Andere Namen |
|
| Verhältnisformel | FeS2 |
| CAS-Nummer | 1309-36-0 1317-66-4 12068-85-8 |
| PubChem | 123110 |
| ECHA-InfoCard | 100.031.903 |
| Kurzbeschreibung |
messinggelbe bis goldgelbe Kristalle (Pyrit) messinggelbe bis grünliche Kristalle (Markasit) |
| Eigenschaften | |
| Molare Masse | 119,98 g/mol |
| Aggregatzustand | fest |
| Dichte |
5,00 g/cm3
(Pyrit) 4,87 g/cm3 (Markasit) |
| Löslichkeit | praktisch unlöslich in Wasser; unlöslich in verdünnten Säuren; löslich in konzentrierter Salzsäure, HNO3 |
Eigenschaften

Reines Eisen(II)-disulfid bildet gold- bzw. messinggelbe Kristalle. In der kubischen Kristallform kommt Eisen(II)-disulfid in der Natur als Pyrit vor. Erhitzt man Pyrit, so spaltet dieser Schwefel ab und verbrennt dabei zu Schwefeldioxid SO2 und Eisen(III)-oxid Fe2O3:
Es reagiert, ebenso wie Eisen(II)-sulfid, mit Säuren unter Bildung von Schwefelwasserstoff (das in diesem Falle zunächst gebildete Disulfan (H2S2) ist bei Normalbedingungen instabil und zerfällt zu H2S und Schwefel).
Verwendung
Früher wurde Eisen(II)-disulfid in großen Mengen für die Herstellung von Schwefelsäure H2SO4 verwendet. Heutzutage wird es für die Kathode der Lithium-Eisensulfid-Batterie benutzt.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 01.08. 2017