Kaliummanganat
| Sicherheitshinweise | ||||||||
|---|---|---|---|---|---|---|---|---|
| ||||||||
Kaliummanganat ist eine anorganische chemische Verbindung des Kaliums aus der Gruppe der Manganate.
| Kristallstruktur | |
|---|---|
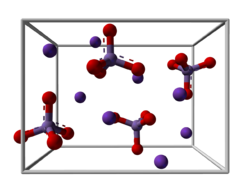 | |
| _ K+ _ Mn6+ _ O2− | |
| Kristallsystem | orthorhombisch |
| Raumgruppe | Pnma (Nr. 62) |
| Allgemeines | |
| Name | Kaliummanganat |
| Andere Namen |
Kaliummanganat(VI) |
| Verhältnisformel | K2MnO4 |
| Kurzbeschreibung | grüner Feststoff |
| Externe Identifikatoren/Datenbanken | |
| CAS-Nummer | 10294-64-1 |
| EG-Nummer | 233-665-2 |
| ECHA-InfoCard | 100.030.592 |
| PubChem | 160931 |
| ChemSpider | 141385 |
| Eigenschaften | |
| Molare Masse | 197,13 g/mol |
| Aggregatzustand | fest |
| Schmelzpunkt | 190 °C (Zersetzung) |
| Löslichkeit |
|
Gewinnung und Darstellung
Kaliummanganat kann durch Reaktion von Kaliumpermanganat mit Kaliumhydroxid gewonnen werden.
Es kann auch durch Reaktion von Mangan(II)-Verbindungen oder Mangan(IV)-oxid mit Kaliumhydroxid und Sauerstoff bzw. Luft oder durch Reaktion von Kaliumnitrat mit Kaliumcarbonat gewonnen werden.
Eigenschaften
Kaliummanganat ist ein grüner paramagnetischer, metallisch glänzender Feststoff. Er besitzt eine orthorhombische Kristallstruktur mit der Raumgruppe Pnma (Raumgruppen-Nr. 62). Er ist stabil in alkalischer wässriger Lösung, aber in neutraler oder saurer Lösung zersetzt er sich in Kaliumpermanganat und Mangan(IV)-oxid.
Verwendung
Es wird als selektives Oxidationsmittel verwendet.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 27.04. 2022

