Phenolrot
| Sicherheitshinweise | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
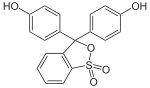
Phenolrot ist ein Triphenylmethanfarbstoff und bildet die Basisverbindung der Familie der Sulfonphthaleine. Es wird als pH-Indikator eingesetzt und besitzt zwei Umschlagsbereiche. Bei pH ≈ 0,9 ändert sich die Farbe von Rot auf Gelb und bei pH ≈ 6,4–8,2 dann von Gelb auf Rotviolett.[4][5]
| Strukturformel | ||
|---|---|---|
| ||
| Allgemeines | ||
| Name | Phenolrot | |
| Andere Namen | ||
| Summenformel | C19H14O5S | |
| Kurzbeschreibung | roter Feststoff mit schwachem Geruch[2] | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer | 143-74-8 | |
| EG-Nummer | 205-609-7 | |
| ECHA-InfoCard | 100.005.100 | |
| PubChem | 4766 | |
| ChemSpider | 4602 | |
| DrugBank | DB13212 | |
| Eigenschaften | ||
| Molare Masse | 354,38 g/mol | |
| Aggregatzustand | fest[2] | |
| Schmelzpunkt | > 300 °C[2] | |
| Löslichkeit | sehr schlecht in Wasser (0,77 g/l−1 bei 100 °C)[2] | |
Darstellung
In einer Friedel-Crafts-Acylierung werden zwei Äquivalente Phenol und ein Äquivalent 2-Sulfobenzoesäureanhydrid in Gegenwart geringer Mengen konzentrierter Schwefelsäure oder Zinkchlorid umgesetzt.
Eigenschaften
Phenolrot ist ein roter Feststoff mit schwachem Geruch.[2]
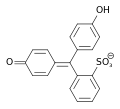
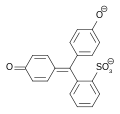
Phenolrot enthält zwei Hydroxygruppen und einen wenig stabilen Sultonring. Im wässrigen Medium wird dieser Ring gespalten, und nach einer Umlagerung entsteht die chinoide gelb gefärbte Form des Farbstoffs. Dieses chinoide System kann im stark sauren Milieu (pH < 1) protoniert werden, wodurch die Lösung sich rot färbt. In neutralem Milieu (pH = 6,4–8,3) wird die Hydroxygruppe deprotoniert und die Lösung färbt sich rotviolett.[4][6] Im stark basischen Bereich (pH > 14) erfolgt eine Anlagerung einer OH-Gruppe unter Bildung einer Triphenylmethanolstruktur. Phenolrot liegt dann als farbloses Trianion vor.
| Spezies | H2In | HIn− | In2− |
|---|---|---|---|
| Struktur | 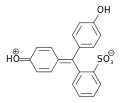 |
 |
|
| pH | < 1 | 1–7,3 | > 7,3 |
| Farbe | Rot | Gelb | Rotviolett |
Verwendung
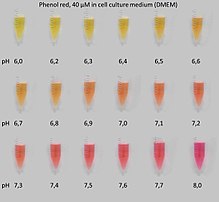
Phenolrot wird bei Säure-Base-Titrationen als Indikator eingesetzt, mit einem Umschlagsbereich zwischen pH 6,4 und 8,2. Der Farbwechsel erfolgt von Rotviolett im Basischen nach Gelb im Sauren. Da sich Phenolrot sehr schlecht in Wasser löst, wird die gebrauchsfertige Lösung hergestellt entweder durch
- Lösen von 0,1 g in 100 ml 20-prozentigem Ethanol oder durch
- Lösen von 0,04 g in 1,13 ml Natronlauge (0,1 mol/l) und anschließendem Auffüllen mit Wasser auf 100 ml.
Phenolrot dient als pH-Indikator für Zellkulturmedien.
Früher wurde das Na-Salz des Phenolrots in der Medizin als Nierenfunktionsdiagnostikum verwendet, da es nach intravenöser Injektion fast ausschließlich renal eliminiert wird (Phenolrotprobe oder Phenolsulfonphthaleinprobe).[7]
Literatur
- Z. Tamura, M. Maeda: Differences between phthaleins and sulfonphthaleins. In: Yakugaku Zasshi. 1997, 117 (10–11), S. 764–770. (jap.); PMID 9414589
Einzelnachweise
- ↑ Eintrag zu PHENOLSULFONPHTHALEIN in der CosIng-Datenbank der EU-Kommission.
- ↑ Hochspringen nach: a b c d e Datenblatt Phenolrot bei Merck.
- ↑ Hochspringen nach: a b Eintrag zu Phenolrot in der GESTIS-Stoffdatenbank des Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung. (JavaScript erforderlich)
- ↑ Hochspringen nach: a b Udo R. Kunze: Grundlagen der quantitativen Analyse. 3. Auflage. Georg Thieme Verlag, Stuttgart 1990, S. 96.
- ↑ Markus Weinmann, Max-Planck-Institut: Sulfonphtaleine – Phenolrot (vom 8. Juli 2007 im Internet Archive)
- ↑ K. Yamaguchi, Z. Tamura, M. Maeda: Molecular Structure of the Zwitterionic Form of Phenolsulfonphthalein. In: Analytical Sciences. 13 (3). 1997, S. 521–522. doi:10.2116/analsci.13.521
- ↑ G.Carstensen. In: Ärztliche Wochenschrift. Nr. 10, 1955, S. 76.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 14.05. 2025
