
Natriumoxid
| Sicherheitshinweise | ||||||||
|---|---|---|---|---|---|---|---|---|
| ||||||||
Natriumoxid ist ein Oxid des Natriums mit der Summenformel Na2O.
| Kristallstruktur | ||
|---|---|---|
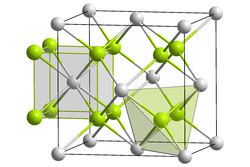
| ||
| _ Na+ _ O2− | ||
| Allgemeines | ||
| Name | Natriumoxid | |
| Andere Namen | ||
| Verhältnisformel | Na2O | |
| Kurzbeschreibung | weißes Pulver[2] | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer | | |
| EG-Nummer | 215-208-9 | |
| ECHA-InfoCard | | |
| PubChem | | |
| Eigenschaften | ||
| Molare Masse | 61,98 g/mol−1 | |
| Aggregatzustand | fest | |
| Dichte | 2,27 g/cm3[2] | |
| Schmelzpunkt | 1275 °C (Sublimation)[3] | |
| Löslichkeit | zersetzt sich in Wasser[2] | |
Herstellung
Es kann direkt aus den Elementen gewonnen werden. Hierbei ist es jedoch erforderlich, die Stöchiometrie der Reaktion sowie die Temperatur zu beachten, da sonst bei Sauerstoffüberschuss auch Natriumperoxid und Natriumhyperoxid gebildet werden.[4]
Die Reaktion wird in einem Temperaturbereich von 150 – 200 °C durchgeführt. Höhere Temperaturen begünstigen die Bildung von Natriumperoxid.
Eine weitere Möglichkeit ist durch die Umsetzung von flüssigem Natrium mit Natriumnitrat gegeben.
Reines Natriumoxid kann durch die Reaktion von Natriumazid mit Natriumnitrat gewonnen werden.[5]
Ebenfalls möglich ist die Reaktion von Natriumhydroxid und Natrium.[5]
Eigenschaften
Es handelt sich um einen farblosen Feststoff, der in einer Antifluoritstruktur kristallisiert.[3] Natriumoxid reagiert heftig mit Wasser unter Bildung von Natriumhydroxid[3]
Die Standardbildungsenthalpie von Natriumoxid beträgt ΔHf0 = −418 kJ/mol.[4]
Verwendung
Natriumoxid wird als Ätzmittel bei der Glasherstellung, zur Polymerisation und als Trockenmittel zum Trocknen organischer Lösemittel verwendet.
Siehe auch
Einzelnachweise
- ↑ Eintrag zu
 SODIUM OXIDE
in der CosIng-Datenbank der EU-Kommission, abgerufen am 26. Dezember 2025.
SODIUM OXIDE
in der CosIng-Datenbank der EU-Kommission, abgerufen am 26. Dezember 2025.
- ↑ Hochspringen nach: a b c d
e Eintrag zu
 Natriumoxid in der
GESTIS-Stoffdatenbank des Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung, abgerufen am 26. Dezember 2025. (JavaScript erforderlich)
Natriumoxid in der
GESTIS-Stoffdatenbank des Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung, abgerufen am 26. Dezember 2025. (JavaScript erforderlich)
- ↑ Hochspringen nach: a b c Eintrag zu
 Natriumoxide. In: Römpp Online. Georg Thieme Verlag,
abgerufen am 26. Dezember 2025.
Natriumoxide. In: Römpp Online. Georg Thieme Verlag,
abgerufen am 26. Dezember 2025.
- ↑ Hochspringen nach: a b A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 1173–1176.
- ↑ Hochspringen nach: a b Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3, S. 951.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 26.12. 2025
