
Triphenylmethan
| Sicherheitshinweise | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
Triphenylmethan, auch Tritan (davon abgeleitet Tritylgruppe für die Triphenylmethylgruppe) genannt, ist eine organische Verbindung, in der drei Phenylringe um ein zentrales Kohlenstoffatom gruppiert sind. Triphenylmethan ist die Muttersubstanz der Triphenylmethanfarbstoffe.
Synthese
| Strukturformel | ||
|---|---|---|
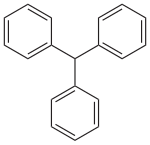
| ||
| Allgemeines | ||
| Name | Triphenylmethan | |
| Andere Namen |
| |
| Summenformel | C19H16 | |
| Kurzbeschreibung | kristalliner, farbloser bis gelblicher Feststoff[1][2] | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer | ||
| EG-Nummer | 208-275-0 | |
| ECHA-InfoCard | ||
| PubChem | ||
| ChemSpider | ||
| Eigenschaften | ||
| Molare Masse | 244,34 g/mol | |
| Aggregatzustand | fest | |
| Dichte | 1,01 g/cm3[2] | |
| Schmelzpunkt | 93 °C[2] | |
| Siedepunkt | 359 °C[2] | |
| Löslichkeit |
| |
| Brechungsindex | 1,5839 (99 °C)[3] | |
Triphenylmethan kann per Friedel-Crafts-Alkylierung aus Benzol und Trichlormethan (Chloroform) oder in wesentlich besserer Ausbeute aus Benzol und Benzalchlorid synthetisiert werden. Es handelt sich hierbei um eine elektrophile aromatische Substitution. Für beide Reaktionen wird die Lewis-Säure Aluminiumtrichlorid (AlCl3) als Katalysator benötigt. Als Nebenprodukt entsteht Chlorwasserstoff.
Eigenschaften
Triphenylmethan ist farblos, in den Farbstoffen liegt jedoch ein delokalisiertes Elektronensystem des entsprechenden Kations oder Anions vor, das durch den mesomeren Effekt der Substituenten stabilisiert wird. Man spricht dann von einem konjugierten π-Elektronensystem. Der Flammpunkt liegt bei > 100 °C.[2]
Da sich die Wasserstoff-Atome der Phenylreste räumlich stören, ist eine planare Anordnung der Ringe nicht möglich, sie liegen daher propellerartig verdreht zueinander vor.
Triphenylmethan lässt sich leicht zu Triphenylmethanol oxidieren. Außerdem wirkt Triphenylmethan als sehr schwache Säure, z. B. kann es mit starken Basen (oder mit Alkalimetallen unter Abspaltung von Wasserstoff) zum Triphenylmethanid-Anion reagieren, das ebenfalls mesomeriestabilisiert ist.
Verwendung
Triphenylmethan bildet den Grundkörper für die Gruppe der Triphenylmethanfarbstoffe (z. B. Indikatoren, Textil- und Lebensmittelfarbstoffe). Zu diesen gehören u. a. Fuchsin, Kristallviolett, Phenolphthalein, Fluorescein, Eosin, Bromphenolblau usw.
Siehe auch
Einzelnachweise
- ↑ Hochspringen nach: a b c Eintrag zu Triphenylmethan. In: Römpp Online. Georg Thieme Verlag.
- ↑ Hochspringen nach: a b
c d e
f Eintrag zu
 Triphenylmethan in der
GESTIS-Stoffdatenbank des Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung.
Triphenylmethan in der
GESTIS-Stoffdatenbank des Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-512.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 18.11. 2025