
Cyclopropan
| Sicherheitshinweise | ||||||||
|---|---|---|---|---|---|---|---|---|
| ||||||||
| MAK | nicht festgelegt | |||||||
Cyclopropan ist ein farbloses, gasförmiges Cycloalkan, das erste Glied in dieser Verbindungsklasse.
Entdeckung
Beim Versuch, das Verfahren der Wurtz-Reaktion (Wurtzsche Synthese) auf α,ω-Dihalogenalkane auszudehnen, entdeckte August Freund im Jahre 1882 einen Kohlenwasserstoff mit der Summenformel C3H6, den er Trimethylen nannte.
Gewinnung und Darstellung
Gustavson fand 1887 eine einfachere, ungefährlichere Synthese, indem er zur Enthalogenierung anstelle des bis dahin üblichen Natriummetalls Zinkstaub in wasserhaltigem Ethanol verwendete. Die Herstellung nach diesem Reaktionsprinzip dürfte auch heute noch die günstigste sein; sie wurde optimiert und auch mit 1,3-Dichlorpropan oder dem leicht zugänglichen 1-Brom-3-chlorpropan realisiert.
| Strukturformel | |
|---|---|
 | |
| Allgemeines | |
| Name | Cyclopropan |
| Andere Namen | Trimethylen |
| Summenformel | C3H6 |
| Kurzbeschreibung | farbloses Gas mit petroletherähnlichem Geruch |
| Externe Identifikatoren/Datenbanken | |
| CAS-Nummer | 75-19-4 |
| EG-Nummer | 200-847-8 |
| ECHA-InfoCard | 100.000.771 |
| PubChem | 6351 |
| ChemSpider | 6111 |
| DrugBank | DB13984 |
| Eigenschaften | |
| Molare Masse | 42,08 g/mol |
| Aggregatzustand | gasförmig |
| Dichte |
|
| Schmelzpunkt | −127,62 °C |
| Siedepunkt | −32,9 °C |
| Löslichkeit | sehr schwer in Wasser (502 mg·l−1) |
| Dipolmoment | 0 |
| Brechungsindex | 1,3799 (−42 °C) |
| Thermodynamische Eigenschaften | |
| ΔHf0 | 53,3 kJ/mol |
Eigenschaften
Physikalische Eigenschaften

Das Molekül gehört zu der Symmetriegruppe D3h. Eine Strukturbestimmung durch Elektronenbeugung ergab einen Abstand der C-Atome von 151,0 pm. Für die C–H-Bindungslänge wurde ein Wert von 108,9 pm ermittelt, und für den H-C-H-Winkel 115,1°.

Die drei Kohlenstoffatome des Cyclopropans müssen notwendigerweise in einer Ebene liegen. Im klassischen, also nicht-quantenchemischen Baeyer-Modell ist daher eine hohe Winkelspannung zu erwarten, außerdem Torsionsspannung (Pitzer-Spannung) durch die ekliptische Position der Wasserstoffatome. Für die Spannungsenergie werden typischerweise 117 kJ/mol (28 kcal/mol) angegeben. Die Strukturdaten zeigen jedoch, dass beim Cyclopropan besondere Bindungsverhältnisse vorliegen müssen. Einfache Modelle, wie das Baeyer-Modell, sind daher nicht angebracht.
Mit dem Konzept streng lokalisierter Sigma-Bindungen kann Cyclopropan nicht verstanden werden. In dem kleinen Molekül treten Wechselwirkungen der Elektronen auf, welche in den größeren Cycloalkanen keine Rolle spielen. Daher weicht Cyclopropan in den physikalischen und chemischen Eigenschaften stark von anderen Cycloalkanen ab.
Quantenchemische Rechnungen nach ab-initio-Verfahren haben ergeben, dass die Elektronenpopulation hohe Werte außerhalb der Kanten des hypothetischen Dreiecks haben, also der Geraden, durch welche man sich die Zentren der C-Atomkerne verbunden denken kann.
Der Physikochemiker Theodor Förster zeigte vermutlich als erster auf, dass beim Cyclopropan die „Valenzrichtung“ von der „Bindungsrichtung“, d.h. der C–C-Bindung in der klassischen Formel, abweicht.
Charles Coulson und W. E. Moffitt entwickelten dieses Orbital-Modell, das später nach ihnen benannt wurde, weiter.
Die Valenzorbitale eines sp3-hybridisierten Kohlenstoffatoms bilden Winkel von 109,4° und besitzen 25 % s-Charakter sowie 75 % p-Charakter. Zwei davon werden für die Bindungen zu den Wasserstoffatomen benutzt. Beim Cyclopropan müssten die restlichen Orbitale dreier CH2-Fragmente kombiniert werden. Der Bereich der Überlappung ist dann aber klein und liegt nicht in der Verbindungslinie der C-Atome.

Die Überlappung wird stärker, wenn man Hybridorbitale mit höherem p-Anteil benutzt. Als Optimum ergab sich ein Orbital, welches nur 17 % s-Charakter für die C–C-Bindung, dagegen 33 % s-Charakter für die C–H-Bindungen besitzt, also als sp5-Orbital bezeichnet werden könnte.
Dies führt zum Bild „gebogener“ C–C-Bindungen (engl. bent bonds), die man salopp auch als „Bananenbindungen“ bezeichnet hat. Die Valenzwinkel (Innenwinkel) der C–C–C-Bindungen betragen 104°.

Das Modell erklärt, warum die C–C-Bindungen kürzer sind als beim Cyclohexan und bei geradkettigen gesättigten Kohlenwasserstoffen (Alkanen) und trotzdem schwächer. Der höhere s-Charakter der C–H-Bindungen wirkt sich in der Kraftkonstante der C–H-Bindung (Infrarot- und Ramanspektrum), der Chemischen Verschiebung und Kopplungskonstanten in NMR-Spektren, und der erhöhten C-H-Acidität des Kohlenwasserstoffs aus.
Ein zweites Orbitalmodell wurde von Arthur Donald Walsh entwickelt. Das Walsh-Modell geht von sp2-Hybridorbitalen für die CH2-Gruppe aus; die „gebogenen“ Bindungen entstehen dann durch Überlappung reiner p-Orbitale.
Cyclische Delokalisation der sechs Elektronen der drei CC-σ-Bindungen des Cyclopropans wurde von Michael J. S. Dewar als Erklärung für die gegenüber Cyclobutan vergleichsweise geringe Spannungsenergie ("nur" 115,6 vs. 109,7 kJ/mol, Referenz Cyclohexan mit Esp = 0 kJ/mol) herangezogen (Stabilisierung durch σ-Aromatizität, vgl. die cyclische Delokalisation der sechs π-Elektronen im Benzol als Paradebeispiel für Aromatizität). Die Annahme eines diamagnetischen Ringstroms im Cyclopropan wird neben der verringerten Spannungsenergie belegt durch in Abschirmung der Cyclopropan-Protonen im NMR sowie durch seine ungewöhnlichen magnetischen Eigenschaften (hohe diamagnetische Suszeptibilität, hohe Anisotropie der magnetischen Suszeptibilität). Neuere Untersuchungen zum Ausmaß der Stabilisierung von Cyclopropan durch σ-Aromatizität schreiben dem Effekt einen Wert von 11,3 kcal mol−1 zu.
Chemische Eigenschaften
Im Vergleich mit höheren Cycloalkanen zeigt Cyclopropan ein besonderes Reaktivitätsmuster: häufig wird eine C–C-Bindung gebrochen. Assoziationsreaktionen sind charakteristisch. Erklärungen wurden unter anderem mit den Konzepten "Spannungsenergie" und "Walsh-Modell" gegeben.
Beim Erhitzen von Cyclopropan, welches mit Deuteriumatomen markiert wurde, beobachtete man eine "geometrische Isomerisierung": cis-1,2-Dideuteriocyclopropan bildet in einer Gleichgewichtsreaktion trans-1,2-Dideuteriocyclopropan.

Die Deuteriumatome ändern also ihre Lage (gr. topos), daher kann man diesen Prozess als Topomerisierung des Moleküls bezeichnen. Ein konzertierter Mechanismus wurde diskutiert.
Bei ca. 500 °C wird Cyclopropan zu Propen umgewandelt. Diese Konstitutionsisomerisierung, untersucht im Bereich von 469,6 bis 518,6 °C, benötigt eine Aktivierungsenergie von ca. 65 kcal mol−1. Als Zwischenstufe wurde ein "Trimethylen-Diradikal" (Propan-1,3-diyl) postuliert.
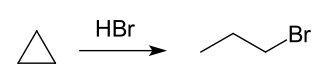
An einem Palladiumkatalysator reagiert Cyclopropan mit Wasserstoff zu Propan. Mit Bromwasserstoff (HBr) reagiert es zu 1-Brompropan, was ebenfalls den "olefinischen Charakter" zeigt. Chlorgas reagiert ebenfalls unter Addition zu 1,3-Dichlorpropan.
Verwendung
In der Vergangenheit wurde es in einer 15–30%igen Mischung mit Sauerstoff als Narkosemittel angewendet, wovon man heute wegen der Nachteile (Explosivität der Dämpfe, schlechte Steuerbarkeit der Narkose, Kardio- und Hepatotoxizität) absieht.
Sicherheitshinweise
Cyclopropan bildet wie alle niederen Kohlenwasserstoffe mit Luft leicht entzündliche Gemische. Der Explosionsbereich liegt zwischen 2,4 Vol.‑% (40 g/m3) als untere Explosionsgrenze (UEG) und 10,4 Vol.‑% (385 g/m3) als obere Explosionsgrenze (OEG). Die Grenzspaltweite wurde mit 0,91 mm bestimmt. Es resultiert damit eine Zuordnung in die Explosionsgruppe IIA. Mit einer Mindestzündenergie von 0,17 mJ sind Dampf-Luft-Gemische extrem zündfähig. Die Zündtemperatur beträgt 495 °C. Der Stoff fällt somit in die Temperaturklasse T1.
Derivate und Substituenten
Zahlreiche Derivate sind durch chemische Synthese herstellbar, z.B. mit Alkylgruppe als Rest. Sie werden in der Erdölindustrie, der Krebsforschung und anderen wissenschaftlichen Gebieten untersucht.
Die Biosynthese wird durch Cyclopropan-Synthase katalysiert, sodass Mykolsäuren entstehen, die ein wesentlicher Faktor dafür sind, dass Tuberkulose nur schwer mit hydrophoben Antibiotika behandelt werden kann. Das Enzym selbst ist eine Methyltransferase, die mittels S-Adenosylmethionin cis- oder trans-Cyclopropan-Ringe in die dort ungesättigte Fettsäure einbaut.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 26.11. 2024

