2,3,7,8-Tetrachlordibenzodioxin
| Sicherheitshinweise | ||||||||
|---|---|---|---|---|---|---|---|---|
| ||||||||
| MAK | 0,01 ng/m3 [1] | |||||||
| Toxikologische Daten | ||||||||
2,3,7,8-Tetrachlordibenzodioxin ist eine chlorhaltige, hochgiftige organische Verbindung. Der systematische Name lautet 2,3,7,8-Tetrachlordibenzo-p-dioxin bzw. 2,3,7,8-Tetrachlordibenzo-1,4-dioxin (gesprochen zwei- drei- sieben- acht- tetrachlor- dibenzo- para- di-oxin). Die Verbindung leitet sich vom Dibenzodioxin ab und wird abgekürzt als 2,3,7,8-TCDD oder nur TCDD, umgangssprachlich häufig auch (fälschlich) als Dioxin oder als Seveso-Dioxin bzw. Seveso-Gift bezeichnet. Der Kurzname Dioxin bezeichnet vielfach unspezifisch die gesamte übergeordnete Stoffgruppe der polychlorierten Dioxine und Dibenzofurane, deren giftigster Vertreter das 2,3,7,8-Tetrachlordibenzodioxin ist.
TCDD kann als unerwünschtes Nebenprodukt bei der Herstellung der wirtschaftlich sehr bedeutsamen chlororganischen Verbindungen (Chlorchemie) und bei der Verbrennung ähnlicher Stoffe entstehen. Typische Konzentrationen liegen dabei im ppm-Bereich, bei vereinzelten schweren Chemie-Unfällen wie dem italienischen Sevesounglück von 1976 entstanden Mengen bis in den Kilogramm-Bereich. TCDD kann in Spuren auch bei Waldbränden entstehen, andere Quellen sind Motorenabgase, Zigarettenrauch, Feuerwerk sowie generell Schwelbrandprozesse bei niederen Temperaturen. Die Verbindung ist ein Gift- bzw. Schadstoff und besitzt keinerlei technischen oder wirtschaftlichen Nutzwert. Analytische Standardverfahren zur Detektierung und Bewertung von polyhalogenierten Dibenzodioxinen und -furanen wurden maßgeblich von Karlheinz Ballschmiter ausgearbeitet.
| Strukturformel | ||
|---|---|---|
(1,4)dioxine_200.svg.png)
| ||
| Allgemeines | ||
| Name | 2,3,7,8-Tetrachlordibenzodioxin | |
| Andere Namen |
| |
| Summenformel | C12H4Cl4O2 | |
| Kurzbeschreibung | farblose Kristalle[1] | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer | | |
| EG-Nummer | 217-122-7 | |
| ECHA-InfoCard | | |
| PubChem | | |
| Eigenschaften | ||
| Molare Masse | 321,97 g/mol | |
| Aggregatzustand | fest | |
| Dichte | 1,83 g/cm3 [1] | |
| Schmelzpunkt | 295 °C[2] | |
| Löslichkeit |
| |
Geschichte
TCDD wurde erstmals 1957[6] von Wilhelm Sandermann[7] im Labor synthetisiert. Er entdeckte auch die Wirkung von TCDD.
Schon im November 1953 war es bei der BASF bei der Chlorierung von Diphenyloxiden zu einem Unfall gekommen, in dessen Folge mehrere Arbeiter an schwerer Chlorakne erkrankten. Ähnliche Fälle ereigneten sich bereits 6 Jahre zuvor in den USA sowie 1952, 1954 und 1956 bei der Firma Boehringer Ingelheim.[8]
Im Vietnamkrieg wurde von 1965 bis 1970 das Entlaubungsmittel Agent Orange eingesetzt, dessen Verunreinigung mit TCDD zu schweren, bis heute andauernden Schädigungen bei Bevölkerung und US-Soldaten führte.
Am 10. Juli 1976 kam es zu dem verheerenden Sevesounglück, bei dem in der norditalienischen Stadt Seveso zwischen einigen hundert Gramm und wenigen Kilogramm an TCDD austraten.[9]
Im Laufe der Präsidentschaftswahlen in der Ukraine 2004 bestätigte sich der Verdacht auf eine Dioxinvergiftung des Kandidaten Wiktor Juschtschenko, als seine Ärzte in seinem Blut und Gewebe mehr als das 50.000fache der normalen Konzentration an TCDD fanden.[10] Juschtschenkos Gesicht zeigt seit dem mutmaßlichen Anschlag starke Chlorakne-Symptome.
Vorkommen und Entdeckung der Bedeutung als Giftstoff
TCDD entsteht zusammen mit anderen polychlorierten Dibenzodioxinen und Dibenzofuranen als Nebenprodukt bei der Synthese der wirtschaftlich sehr bedeutenden organischen Chlorverbindungen (beispielsweise Halogenphenoxycarbonsäure-Herbizide) oder der Verbrennung von chlor- und kohlenwasserstoffhaltigen Verbindungen. Durch entsprechende Auslegung und Steuerung der chemischen Herstellungsprozesse, insbesondere der eingesetzten Reaktionstemperaturen, lässt sich die unerwünschte Dioxin-Synthese nahezu vollständig vermeiden. Dies war allerdings in den ersten Jahrzehnten der industriellen Produktion und Verwendung dieser Stoffklasse noch kaum erforscht bzw. bekannt, da Dioxin erst 1957 entdeckt wurde und auch das Wissen um seine unerwünschte Entstehung und hohe Giftigkeit erst nach und nach durch das Auftreten entsprechender Gesundheitsschäden entstand.[6]
Wegen des extremen Bedeutungszuwachses der organischen Chlorverbindungen in der zweiten Hälfte des 20. Jahrhunderts – insbesondere im Pflanzenschutz, der Kunststoff- und Flammschutzmittelherstellung – gewann ab etwa den 1950er Jahren das Problem der unerwünschten Dioxin-Entstehung bei solchen Herstellungsprozessen zunehmend an Bedeutung. Zunächst zeigte sich dies vor allem an vermehrten Gesundheitsschäden von Arbeitern in der chemischen Industrie, etwa der (unter anderem) Dioxin-induzierten Chlorakne, wobei nach den Verursachern der schweren Gesundheitsschäden zunächst vergeblich intensiv gesucht wurde.[6]
Während in der so genannten „Chlorchemie“ durch Anpassung der industriellen Fertigungsmethoden und Prozesse die Dioxin-Problematik heute weitgehend als gelöst gilt, gelten Müllverbrennungsanlagen nach wie vor als potenzielle Dioxinquelle – dort entsteht es im Beisein chlorhaltiger Verbindungen wie etwa PVC während der Verbrennung. Moderne Verbrennungsanlagen führen daher eine Nacherhitzung auf über 1200 °C mit anschließender schneller Abkühlung durch, wodurch die TCDD-Konzentration auf Bruchteile reduziert wird.
Eigenschaften
2,3,7,8-Tetrachlordibenzodioxin ist ein langlebiger, sehr giftiger Schadstoff, der bei Raumtemperatur in kristalliner Form vorliegt. Außerdem ist er gut in organischen Lösungsmitteln löslich und lipophil (gut löslich in Fett und Öl),[11] weshalb er sich auch im menschlichen Fettgewebe anreichert. Der logarithmierte Octanol-Wasser-Verteilungskoeffizient log KOW von TCDD beträgt 6,80.[12]
Verwendung
TCDD ist wie alle anderen Dioxine und Furane ein unerwünschtes Nebenprodukt ohne wirtschaftlichen Nutzen. Es gibt derzeit keine kommerzielle Verwendung für diese Stoffgruppe.
In der tierexperimentellen Forschung wird es als Agonist für den Aryl-Hydrocarbon-Rezeptor (abgekürzt Ah-Rezeptor) eingesetzt.
Bedingungen und Mechanismus der Entstehung
Dioxine werden nicht gezielt hergestellt, außer für Zwecke der Forschung und der Chemischen Analytik. Sie entstehen als Nebenprodukte bei einer Vielzahl von thermischen Prozessen bei Vorhandensein bestimmter Ausgangsstoffe. Das hier behandelte TCDD entsteht dabei in der Regel als Stoffgemisch zusammen mit anderen Dioxinen, also Stoffen, die etwa eine andere Anzahl von Chloratomen (als vier beim TCDD) auch an anderen Positionen (als 2,3,7,8) des Dibenzodioxin-Grundgerüsts enthalten.
Bei der Verbrennung von organischen (kohlenstoffhaltigen) Verbindungen in Gegenwart von organischen oder anorganischen Halogenverbindungen (speziell Chlor oder Brom) können sie sich in einem Temperaturbereich von etwa 300–600 °C bilden, der Dioxin-Fenster genannt wird.[13] Verbrennungsprozesse mit möglicher Dioxinbildung sind beispielsweise die Feuerbestattung in Krematorien und die Müllverbrennung, die bis in die 1980er Jahre eine der Hauptursachen für die Dioxinerzeugung war. Seit 1990 in Deutschland strengere Grenzwerte eingeführt wurden, ist die Dioxinbelastung durch Müllverbrennungsanlagen und die Feuerbestattung auf heute praktisch null zurückgegangen. Weitere industrielle Prozesse, bei denen Dioxine entstehen können, sind beispielsweise:
- Bleichprozesse mit Chlor in der Papierherstellung
- die Herstellung von Pflanzenschutzmitteln
- metallurgische Prozesse (z. B. Eisen- und Stahlherstellung)
- Herstellung von Chlorphenolen.
Kritisch ist vor allem die Hitzeeinwirkung auf polychlorierte, das heißt mehrfach chlorierte Phenole. Besonders leicht kondensieren diese in Gegenwart von Alkali über die Phenolate zu Dioxin. So wird 2,3,7,8-TCDD aus dem Natriumsalz von 2,4,5-Trichlorphenol (2,4,5-TCP) gebildet:

In der Icmesa-Chemiefabrik im italienischen Seveso, in der 1976 mit dem so genannten Sevesounglück der bekannteste Chemieunfall mit massiver TCDD-Freisetzung stattfand, wurde Trichlorphenol (TCP, in der Grafik unten in der Mitte) hergestellt. Dieses diente als Vorprodukt für das Desinfektionsmittel Hexachlorophen. Aus dem Ausgangsstoff Tetrachlorbenzol (links) entstand TCP durch Zugabe von alkalischem Natriumhydroxid (NaOH):
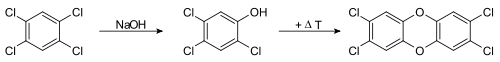
Reaktionsablauf
Bei dieser Reaktion entsteht als Nebenprodukt, besonders bei erhöhter Temperatur, 2,3,7,8-Tetrachlordibenzodioxin (rechts). Der Unfall passierte in einem Reaktionsgefäß (Autoklav), dessen Temperatur nach Abschluss eines Produktionszyklus nicht mehr überwacht wurde. Nach unsachgemäßer Abschaltung des mechanischen Rührwerks für das Gefäß entstand in Folge ein nachträglicher Hitzestau. Dieser führte zur Bildung großer Mengen von TCDD und einem starken Druckanstieg, worauf sich ein Sicherheitsventil öffnete und eine erhebliche Menge des stark dioxinhaltigen Gemischs direkt in die bewohnte Umgebung der Fabrik abgeblasen wurde.[14][15][16]
Gesundheitsgefährdende Wirkungen
Die letale Dosis beim Menschen ist nicht bekannt, im Tierversuch lag die tödliche Dosis bei peroraler Verabreichung je nach Tierart zwischen 0,5 (Meerschweinchen) und 1157 µg/kg Körpergewicht (Hamster).[5] Kontakt mit TCDD kann zum Auftreten von Chlorakne führen, die als Symptom einer schweren Dioxinvergiftung gilt. Eine solche Vergiftung kann auch zu schweren Organschäden, insbesondere der Leber führen. Eine potenziell mutagene Wirkung, das heißt eine Schädigung des Erbguts, ist nicht eindeutig nachgewiesen. Auch die Frage, ob Dioxine Missbildungen beim Nachwuchs auslösen können (teratogene Wirkung), lässt sich nicht mit Gewissheit beantworten.
In Vietnam und den USA wurden vielfach teratogene Fehlbildungen bei Nachfahren von mit Agent Orange – das neben 2,4,5-T als Herbizid auch Verunreinigungen von TCDD enthielt – kontaminierten Personen festgestellt. Eine Meta-Studie, die 2006 im International Journal of Epidemiology veröffentlicht wurde und 22 Studien von 1966 bis 2002 auswertete, kam zum Ergebnis:[17] Parental exposure to Agent Orange appears to be associated with an increased risk of birth defects.
Weiterhin gilt es als sicher, dass Dioxine Krebs verursachen können.[1] Ob TCDD dabei direkt kanzerogen wirkt, oder als Tumorpromotor fungiert, ist nicht abschließend geklärt.
Die Giftwirkung des TCDD wird nach heutigem Kenntnisstand über Aktivierung des Ah-Rezeptors vermittelt, der – ähnlich wie die Rezeptoren für Steroidhormone und Schilddrüsenhormone – an bestimmte regulatorische DNA-Sequenzen binden kann und dadurch die Expression verschiedener Gene reguliert. Als natürlicher Ligand des Ah-Rezeptors wird ITE vermutet (siehe Abbildung). Die TCDD-vermittelte Aktivierung des Ah-Rezeptors führt unter anderem zu einer starken Induktion des Cytochrom P450.
Metaboliten
Bei toxikokinetischen Untersuchungen zur Vergiftung des ukrainischen Präsidentschaftskandidaten Wiktor Juschtschenko wurden zwei Metaboliten in Serum, Urin und Fäzes nachgewiesen. Dabei handelt es sich um 2,3,7-Trichlor-8-hydroxydibenzo-p-dioxin und 1,3,7,8-Tetrachlor-2-hydroxydibenzo-p-dioxin. Als Haupteliminierungsroute aus dem menschlichen Organismus wurden die Fäzes ermittelt. Der Nachweis erfolgte durch Koppelung der Kapillar-Gaschromatographie mit der Massenspektrometrie, wie bei der Analytik der PCDD üblich.[10]
-
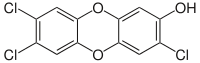 2,3,7-Trichlor-8-hydroxydibenzo-p-dioxin
2,3,7-Trichlor-8-hydroxydibenzo-p-dioxin -
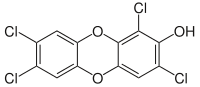 1,3,7,8-Tetrachlor-2-hydroxydibenzo-p-dioxin
1,3,7,8-Tetrachlor-2-hydroxydibenzo-p-dioxin
Einzelnachweise
- ↑ Hochspringen nach: a b
c d e
Eintrag zu
 2,3,7,8-Tetrachlordibenzodioxin in der
GESTIS-Stoffdatenbank des Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung. (JavaScript erforderlich)
2,3,7,8-Tetrachlordibenzodioxin in der
GESTIS-Stoffdatenbank des Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung. (JavaScript erforderlich)
- ↑ Mary Lide, David R. Lide: CRC Handbook of Chemistry and Physics. 87. Auflage, CRC Press, 2007, ISBN 978-0-8493-0594-8, S. 470.
- ↑ Hochspringen nach: a b Eintrag zu 2,3,7,8-Tetrachlordibenzo[1,4]dioxin. In: Römpp Online. Georg Thieme Verlag.
- ↑ Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung
durch Inverkehrbringer abgeleitete Kennzeichnung von
 2,3,7,8-tetrachlorodibenzo[b,e][1,4]dioxin
im Classification and Labelling Inventory der Europäischen Chemikalienagentur
(ECHA).
2,3,7,8-tetrachlorodibenzo[b,e][1,4]dioxin
im Classification and Labelling Inventory der Europäischen Chemikalienagentur
(ECHA).
- ↑ Hochspringen nach: a b
c d e
f g Eintrag zu
 2,3,7,8-Tetrachlorodibenzo-p-dioxin
in der PubChem-Datenbank der United States National Library of Medicine (NLM).
2,3,7,8-Tetrachlorodibenzo-p-dioxin
in der PubChem-Datenbank der United States National Library of Medicine (NLM).
- ↑ Hochspringen nach: a b
c Wilhelm Sandermann:
 Dioxin.
Die Entdeckungsgeschichte des 2,3,7,8-Tetrachlordibenzo-p-dioxins (TCDD, Dioxin, Sevesogift) (im Internet Archive) 1984.
Dioxin.
Die Entdeckungsgeschichte des 2,3,7,8-Tetrachlordibenzo-p-dioxins (TCDD, Dioxin, Sevesogift) (im Internet Archive) 1984.
- ↑
 Biografie von Wilhelm Sandermann
(im Internet Archive).
Biografie von Wilhelm Sandermann
(im Internet Archive).
- ↑ Mechthild Lindemann:
 Deutsche Wissenschaftler als Erfinder von „Agent Orange“? Eine Spurensuche in:
Vierteljahrshefte für Zeitgeschichte Jahrgang 64 (2016), Heft 1, S. 69ff. (pdf)
Deutsche Wissenschaftler als Erfinder von „Agent Orange“? Eine Spurensuche in:
Vierteljahrshefte für Zeitgeschichte Jahrgang 64 (2016), Heft 1, S. 69ff. (pdf)
- ↑ P. A. Bertazzi, I. Bernucci, G. Brambilla, D. Consonni, A. C.
Pesatori: The Seveso studies on early and long-term effects of dioxin exposure: a review. In:
Environmental Health Perspectives. 106. Jahrgang, April 1998,
S. 625–633,
doi:
 10.1289/ehp.98106625.
10.1289/ehp.98106625.
- ↑ Hochspringen nach: a b O. Sorg, M. Zennegg, P. Schmid, R.
Fedosyuk, R. Valikhnovskyi, O. Gaide, V. Kniazevych, J.-H. Saurat: 2,3,7,8-tetrachlorodibenzo-p-dioxin (TCDD) poisoning in Victor Yushchenko:
identification and measurement of TCDD metabolites. In: The Lancet.
Band 374, Nr. 9696,
2009, S. 1179–1185,
doi:
 10.1016/S0140-6736(09)60912-0,
10.1016/S0140-6736(09)60912-0,
 PMID 19660807.
PMID 19660807.
- ↑ Ottfried Strubelt: Gifte in Natur und Umwelt. Pestizide und Schwermetalle, Arzneimittel und Drogen. Spektrum Akademischer Verlag, Heidelberg/Berlin/Oxford 1996, S. 183–192.
- ↑ Rene P. Schwarzenbach, Philip M. Gschwend, Dieter M. Imboden: Environmental Organic Chemistry. Wiley-Interscience, Hoboken, New Jersey 2003, ISBN 0-471-35750-2.
- ↑ Gordon McKay: Dioxin characterisation, formation and minimisation during
municipal solid waste (MSW) incineration: review. In: Chemical Engineering Journal. Band 86,
Nr. 3, 2002, S. 343–368,
doi:
 10.1016/S1385-8947(01)00228-5.
10.1016/S1385-8947(01)00228-5.
- ↑ P.A. Bertazzi, I. Bernucci, G. Brambilla, D. Consonni, A.C. Pesatori: The Seveso studies on early and
long-term effects of dioxin exposure: a review. In: Environmental Health Perspectives. 106 (Suppl 2), 1998, S. 625–633,
 PMC 1533388 (freier Volltext).
PMC 1533388 (freier Volltext).
- ↑
 „Ich war absolut dumm“
(Interview der taz mit Jörg Sambeth, 10. Juli 2006).
„Ich war absolut dumm“
(Interview der taz mit Jörg Sambeth, 10. Juli 2006).
- ↑ H. Künzi: Thermische Sicherheitsuntersuchungen eines Natrium-2,4,5-trichlorphenolat-Reaktionsgemischs, in Chimia 36 (1982), 162–168.
- ↑ Anh D. Ngo, Richard Taylor, Christine L. Roberts, Tuan V. Nguyen: Association
between Agent Orange and birth defects: systematic review and meta-analysis. In: International Journal of Epidemiology.
Band 35, Nr. 5, 2006,
S. 1220–1230,
doi:
 10.1093/ije/dyl038,
10.1093/ije/dyl038,
 PMID 16543362.
PMID 16543362.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 04.06. 2025

