Ligand
Ein Ligand (lat. ligare = „binden“) ist in der Komplexchemie (sowie in Organometallchemie und Bioanorganik) ein Atom oder Molekül, welches über eine koordinative Bindung (veraltet auch „dative Bindung“) an ein zentrales Metall-Ion binden („koordinieren“) kann. Die koordinative Bindung kommt durch den Lewis-Charakter der beteiligten Bindungspartner zustande: Liganden sind Lewis-Basen (Elektronenpaar-Donatoren), Metallionen Lewis-Säuren (Elektronenpaar-Akzeptoren).
Die Besonderheit der koordinativen Bindung besteht darin, dass (im Unterschied zur klassischen kovalenten Bindung) beide Bindungselektronen vom Liganden zur Verfügung gestellt werden: ein Ligand muss dementsprechend über mindestens ein freies Elektronenpaar verfügen (Lewis-Base). Komplexverbindungen sind zum Beispiel das rote Blutlaugensalz (Kaliumhexacyanidoferrat(III)), bei dem das zentrale Eisen(III)-Ion von sechs Liganden, in diesem Fall Cyanid-Ionen, umgeben ist.
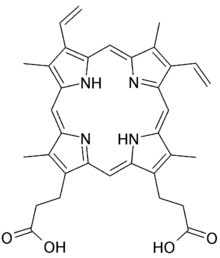
Beispiele aus der Bioanorganik sind das Häm und das Chlorophyll: hier agieren die vier Stickstoffatome im Porphyringerüst als mehrzähniger Ligand für das zentrale Eisen- bzw. Magnesium-Ion.
Die Beschreibung der Metall-Ligand-Bindung als rein donative Bindung ist stark vereinfachend. Vor allem bei schweren Übergangsmetall-Ionen haben die Bindungen meist einen hohen klassisch-kovalenten Anteil (beispielsweise bei Hydrid-Liganden). Auch spielen Rückbindungseffekte vom Metall zum Ligand oftmals eine entscheidende Rolle bei der Bindungsstärke (Bindungsenergie). Dies ist bei vielen Liganden mit π-Systemen der Fall, da die Metallzentren Elektronendichte in die π*-Orbitale verschieben können; Beispiele für solche Liganden sind CO, dessen Komplexe als Metallcarbonyle bezeichnet werden, und Ethen.
Liganden werden traditionell nach ihrer Ladung klassifiziert: negativ geladene Liganden werden als X-Typ abgekürzt (Beispiel Halogenide), während neutrale Liganden als L-Typ abgekürzt werden (Beispiel Phosphane).
In der metallorganischen Chemie werden Liganden seit jeher eingesetzt, um aktive Metallzentren stabil in Lösung zu halten und sie daran zu hindern, zu metallischen Kolloiden (Nanopartikeln) zu agglomerieren. Diese löslichen Metallkomplexe können durch geeignete Wahl der elektronischen und sterischen Eigenschaften der Liganden zu hochaktiven Katalysatoren für die homogene Katalyse optimiert werden.
Siehe auch


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 21.04. 2024