
Triethylaluminium
| Sicherheitshinweise | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| |||||||||
Triethylaluminium, auch als TEA oder Aluminiumtriethyl (ATE) bezeichnet, ist eine metallorganische Verbindung des Aluminiums. Die Verbindung ist pyrophor und kann sich bei Kontakt mit der Luft selbst entzünden. Mit Wasser reagiert TEA äußerst heftig zu Aluminiumhydroxid und Ethan. TEA ist aufgrund der Elektronenlücke am Aluminiumatom, welches nur sechs Valenzelektronen aufweist, eine Lewis-Säure.
| Strukturformel | ||
|---|---|---|
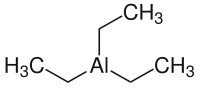 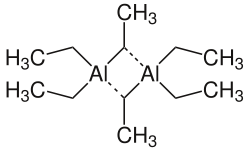
| ||
| Monomer (oben), Dimer (unten) | ||
| Allgemeines | ||
| Name | Triethylaluminium | |
| Andere Namen |
| |
| Summenformel | C6H15Al (monomer) | |
| Kurzbeschreibung | farblose selbstentzündliche Flüssigkeit | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer | ||
| EG-Nummer | 202-619-3 | |
| ECHA-InfoCard | ||
| PubChem | ||
| Eigenschaften | ||
| Molare Masse | 114,17 g/mol | |
| Aggregatzustand | flüssig | |
| Dichte | 0,8324 g/cm3 (25 °C) | |
| Schmelzpunkt | −52,5 °C | |
| Siedepunkt | 187 °C | |
| Dampfdruck | 4 hPa (bei 20 °C) | |
| Löslichkeit | heftige Zersetzung in Wasser | |
Darstellung und Gewinnung
Die technische Synthese erfolgt durch Umsetzung von Aluminium, Wasserstoff und Ethen, wobei eine Startmenge an Triethylaluminium notwendig ist. Aluminium allein reagiert nicht direkt mit Wasserstoff. In Gegenwart von Triethylaluminium wird als Zwischenverbindung Diethylaluminiumhydrid gebildet, welches mit Ethen die Zielverbindung ergibt.
und
Die Summengleichung lautet dann
Die Synthese kann als kontinuierlicher Zweistufenprozess durchgeführt werden, wobei ein Teil des Triethylaluminiums im Kreislauf geführt wird.
Eine zweite Synthesevariante geht von der Umsetzung von Aluminium mit Ethylchlorid aus, wo zunächst das Ethylaluminiumsesquichlorid erhalten wird.
Eine Reduktionsreaktion mit Natrium ergibt dann die Zielverbindung.
und
Eigenschaften
Physikalische Eigenschaften
Triethylaluminium ist eine pyrophore, farblose bis gelbliche Flüssigkeit. Bei Normaldruck siedet die Verbindung bei 187 °C. Die Verdampfungsenthalpie beträgt hier 73,2 kJ·mol−1. Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 7,41394, B = 3451,295 und C = 2,14 im Temperaturbereich von 330 K bis 399 K. Der Schmelzpunkt der Verbindung liegt bei −50,7 °C. Die Schmelzenthalpie beträgt 10,6 kJ·mol−1. Der Tripelpunkt liegt bei −48 °C. und 0.0017 Pa.
Chemische Eigenschaften
In festem und flüssigen Zustand liegt Triethylaluminium als Dimer vor, in der Gasphase dagegen in monomerer Form. Mit Alkalihalogeniden und -cyaniden werden 1:1-Komplex des Typs M[(C2H5)3AlX] sowie 1:2-Komplexe des Typs M[(C2H5)6Al2X] (mit M - Alkalimetallion und X - Halogenid, Cyanid) gebildet. Beim Eintrag von festen, wasserfreien Aluminiumhalogeniden in Triethylaluminium entstehen je nach Stöchiometrie die entsprechenden Diethylaluminiumhalogenide bzw. Ethylaluminiumdihalogenide.
und
mit X = Cl, Br, I
Eine echte Umalkylierung gelingt bei der Umsetzung mit Zinkchlorid, wobei das gewünschte Diethylzink vom Nebenprodukt Diethylaluminiumchlorid destillativ abgetrennt werden kann.
Mit Sauerstoff wird in einer Radikalkettenreaktion an den Aluminium-Kohlenstoff-Bindungen das Aluminiumtriethanolat gebildet. Diese Reaktion verläuft mit einer Reaktionsenthalpie von −1017 kJ·mol−1 sehr stark exotherm, so dass eine entsprechende Reaktionskontrolle hinsichtlich der Sauerstoffzufuhr notwendig ist, um unkontrollierte Selbstentzündungsprozesse zu vermeiden.
Triethylaluminium reagiert bereitwillig und heftig mit protischen Substanzen, wie Mineralsäuren, Wasser, Alkoholen, Mercaptanen, Phenolen, Carbonsäuren, Ammoniak, Aminen, Acetylen und monosubstituierten Acetylenen.
Verwendung
Triethylaluminium ist als Bestandteil von Ziegler-Natta-Katalysatoren ein in großtechnischem Maßstab verwendeter Cokatalysator für die Polyolefinherstellung; vor allem von Polyethylen und Polypropylen. Im sogenannten Alfol-Prozess wird TEA zur Synthese höherer unverzweigter primärer Alkohole („Fettalkohole“) aus Ethen verwendet.
In MOCVD- und MBE-Anlagen wird Triethylaluminium als Reaktionsmedium zur Abscheidung von III-V-Halbleiterschichten, beispielsweise für LEDs, verwendet.
In Kriegswaffen, wie beispielsweise Flammenwerfern, wird Triethylaluminium als flüssiges Brandmittel oder mit Verdickern, wie Polyisobutylen als Gelbrandstoff (TPA, engl. thickened pyrophoric agent) eingesetzt. Prinzipiell können solche Waffen als Nachfolger des Napalms betrachtet werden. Bezüglich der Abbrandtemperatur und der brandstiftenden Wirkung übertreffen sie dieses. TEA selbst kann mit Wasser nicht gelöscht werden, da es explosionsartig mit Wasser reagiert. Wird es mit anderen Löschmitteln bekämpft, so kann jederzeit durch Luftkontakt wieder eine Selbstentzündung einsetzen.
Sicherheitshinweise
Die Dämpfe von Triethylaluminium sind stark reizend und verätzen die Schleimhäute. Mit bis zu zwei Tagen Verzögerung kann ein Lungenödem eintreten. Häufig wird auch das sogenannte Gießerfieber beobachtet. Bei Einwirkungen auf die Haut können sehr schmerzhafte und schwer heilende Wunden entstehen.
Literatur
- K. Ziegler, H.-G. Gellert, H. Lehmkuhl, W. Pfohl, K. Zosel: Metallorganische Verbindungen, XXVI Aluminiumtrialkyle und Dialkyl-Aluminiumhydride aus Olefinen, Wasserstoff und
Aluminium. In: Liebigs Ann. Chem. 629, 1960, S. 1–13.
 doi:10.1002/jlac.19606290102.
doi:10.1002/jlac.19606290102.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 17.12. 2024

