Tetramethylsilan
| Sicherheitshinweise | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
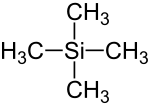
Tetramethylsilan (TMS) ist eine chemische Substanz mit der Konstitutionsformel Si(CH3)4, die aus einem zentralen Silicium-Atom (Si) und vier daran gebundenen Methylgruppen (–CH3) besteht.
| Strukturformel | ||
|---|---|---|
| ||
| Allgemeines | ||
| Name | Tetramethylsilan | |
| Andere Namen |
| |
| Summenformel | C4H12Si | |
| Kurzbeschreibung | farblose Flüssigkeit mit charakteristischem Geruch | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer | ||
| EG-Nummer | 200-899-1 | |
| ECHA-InfoCard | ||
| PubChem | ||
| Eigenschaften | ||
| Molare Masse | 88,23 g/mol | |
| Aggregatzustand | flüssig | |
| Dichte | 0,65 g/cm3 | |
| Schmelzpunkt |
| |
| Siedepunkt | 26 °C | |
| Dampfdruck |
| |
| Löslichkeit | nahezu unlöslich in Wasser (20 mg/l bei 25 °C) | |
| Brechungsindex | 1,3587 (20 °C) | |
Darstellung
Tetramethylsilan lässt sich durch die Grignard-Reaktion aus Siliciumtetrachlorid und Methylmagnesiumchlorid synthetisieren. Es lässt sich auch durch Reaktion von Chlortrimethylsilan mit Natriummethylaluminiumchlorid darstellen.
Eine der ersten Synthesen von Tetramethylsilan gelang 1865 James Mason Crafts und Charles Friedel durch Umsetzung von Siliciumtetrachlorid mit Dimethylzink bei 200 °C.
Eigenschaften
Physikalische Eigenschaften
Tetramethylsilan ist eine niedrig siedende farblose Flüssigkeit. Der Siedepunkt unter Normaldruck liegt bei 26 °C. Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 3,97703, B = 1047,272 und C = −36,057 im Temperaturbereich von 208,93 bis 293.64 K. In fester Phase existieren drei polymorphe Kristallformen. Die folgende Tabelle zeigt die Schmelzpunkte, Schmelzenthalpien und Schmelzentropien. Alle Kristallformen stehen monotrop zueinander.
| Polymorphe Formen von Tetramethylsilan | ||||||||||||
| Tf in K | Tf in °C | ΔfH in kJ·mol−1 | ΔfS in J·K−1·mol−1 | |||||||||
| α-Form | 165,92 | −107,23 | 0,703 | 4,24 | ||||||||
| β-Form | 171,02 | −102,13 | 5,878 | 34,37 | ||||||||
| γ-Form | 174,07 | −99,08 | 6,874 | 39,51 | ||||||||
Chemische Eigenschaften
Tetramethylsilan ist als Flüssigkeit oder Dampf extrem entzündbar. Es bildet leicht entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt unterhalb von −20 °C. Der Explosionsbereich liegt zwischen 1,0 Vol.‑% (36 g/m³) als untere Explosionsgrenze (UEG) und 37,9 Vol.‑% (1385 g/m³) als obere Explosionsgrenze (OEG). Die Grenzspaltweite wurde mit 0,65 mm bestimmt. Es resultiert damit eine Zuordnung in die Explosionsgruppe IIB. Die Zündtemperatur beträgt 330 °C. Der Stoff fällt somit in die Temperaturklasse T2. Tetramethylsilan ist in Wasser nahezu unlöslich.
Verwendung
Als Referenz in der NMR-Spektroskopie
TMS wird in der NMR-Spektroskopie als Standardsubstanz für die Kalibrierung der chemischen Verschiebung von 1H- und 13C-Spektren in organischen Lösungsmitteln verwendet. Dem TMS-Signal wird eine chemische Verschiebung von 0 ppm zugeordnet. Es eignet sich für diesen Zweck aus folgenden Gründen besonders gut:
- TMS liefert in beiden Spektren jeweils ein einziges intensives Signal.
- Das Signal liegt wegen der geringen Elektronegativität von Silicium bei einer niedrigeren Frequenz als die Signale gewöhnlicher organischer Verbindungen.
- TMS ist chemisch weitgehend inert und kann deshalb der Probe als interner Standard zugefügt werden.
- TMS ist leicht flüchtig und kann daher nach der Messung leicht wieder entfernt werden.
Alternativen
In wässrigen Lösungen, in denen TMS quasi unlöslich ist, werden stattdessen die wasserlöslichen Derivate DSS (2,2-Dimethyl-2-silapentan-5-sulfonsäure, Natriumsalz) oder TSP (3-(Trimethylsilyl)-propionsäure, Natriumsalz) verwendet. In organischen Lösungsmitteln kann alternativ zu TMS auch Octamethylcyclotetrasiloxan (OMS) verwendet werden, falls ein höherer Siedepunkt erwünscht ist.
Als Methylierungsmittel
Obwohl TMS – wie oben angegeben – weitgehend inert ist, wurde es erfolgreich als Methylierungsmittel in Transmetallierungsreaktionen eingesetzt:
Sicherheitshinweise
Die Dämpfe sind reizend für die Augen und die Atemwege, in höheren Konzentrationen besteht eine narkotische Wirkung.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 14.05. 2024
