Peroxyessigsäure
| Sicherheitshinweise | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||
| Toxikologische Daten | ||||||||||
Die Peroxyessigsäure (Abk.: PES) ist eine farblose, stechend riechende Flüssigkeit, die sich chemisch von der Essigsäure ableitet und zu den Peroxycarbonsäuren (und damit zu den Peroxiden) gehört. In höheren Konzentrationen kann sich Peroxyessigsäure explosiv zersetzen.
| Strukturformel | ||
|---|---|---|
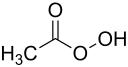 | ||
| Allgemeines | ||
| Name | Peroxyessigsäure | |
| Andere Namen |
| |
| Summenformel | C2H4O3 | |
| Kurzbeschreibung | farblose, stechend riechende Flüssigkeit | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer | 79-21-0 | |
| EG-Nummer | 201-186-8 | |
| ECHA-InfoCard | 100.001.079 | |
| PubChem | 6585 | |
| DrugBank | DB14556 | |
| Eigenschaften | ||
| Molare Masse | 76,05 g/mol | |
| Aggregatzustand | flüssig | |
| Dichte | 1,226 g/cm3 (25 °C) | |
| Schmelzpunkt | 0,1 °C | |
| Siedepunkt | ab 40 °C Zersetzung, ab 100 °C Explosionsgefahr | |
| Dampfdruck | 2055 Pa (25 °C) | |
| Löslichkeit |
| |
Geschichte
Peroxyessigsäure war schon bekannt, kurz nachdem Wasserstoffperoxid im Labor hergestellt werden konnte. Aufgrund ihrer Sensibilität gegenüber Metallspuren lernte man jedoch erst um 1930, sie industriell einzusetzen. Dennoch passierten viele Unfälle und sie konnte sich nicht durchsetzen, bis ab 1960 Kunststoffgefäße für Transport und Lagerung zur Verfügung standen. Danach entdeckte man in den einzelnen Ländern unterschiedliche Anwendungen, die größere Produktionsmengen rechtfertigten.
Peroxyessigsäure (Peressigsäur) ist für den Einsatz in landwirtschaftlichen Betrieben, Lebensmittelbetrieben, medizinischen Einrichtungen und häuslichen Badezimmern. Peressigsäure ist auch für die Verwendung in Molkerei- und Käseverarbeitungsbetrieben, in Lebensmittelverarbeitungsanlagen und in Pasteurisierern in Brauereien, Weinkellereien und Getränkefabriken zugelassen.
Peressigsäure kann als Wasserdesinfektionsmittel für Kühltürme verwendet werden, wo sie die Bildung von Biofilmen verhindert und Legionellen wirksam bekämpft Bakterien.
Dekontaminationskits zur Reinigung von Fentanyl-Analoga von Oberflächen (wie sie unter anderem von vielen Polizeikräften verwendet werden) enthalten oft festes Peracetylborat, das sich mit Wasser vermischt, um Peressigsäure zu produzieren.
Gewinnung und Darstellung
Peroxyessigsäure wird durch Mischen von Essigsäure mit Wasserstoffperoxid hergestellt. Dabei bildet sich eine Gleichgewichtsmischung von Peroxyessigsäure, Essigsäure, Wasserstoffperoxid und Wasser.
Die Gleichgewichtseinstellung wird durch starke Säuren (Schwefelsäure) beschleunigt. Da das Verdünnen einer Peroxyessigsäurelösung automatisch zur Einstellung eines neuen Gleichgewichtes mit niedrigerem Peroxyessigsäuregehalt führt, ist die Lagerung verdünnter Reste nicht sinnvoll.
Kommerziell erhältlich ist Gleichgewichtsperoxyessigsäure in Konzentrationen zwischen 2,5 % und 40 %. Eine Alternative ist die Vakuumdestillation der Peroxyessigsäure aus einer Gleichgewichtsmischung. Wegen der Nähe der Siedepunkte erhält man dabei 38 % bis 40 % Peroxyessigsäure zusammen mit Wasser. Diese Mischung ist nicht stabil und muss zur Lagerung und zum Transport auf 0 °C gekühlt bleiben. Sie wird zur TCF-(Total-Chlor-Freien) Bleiche von Sulfatzellstoff verwendet.
Technisch kann PES durch Oxidation von Acetaldehyd hergestellt werden.
Eigenschaften
Beim Erhitzen zerfällt Peroxyessigsäure explosionsartig. Die mittels DSC bestimmte Zersetzungswärme beträgt −204 kJ·mol−1 bzw. −2682 kJ·kg−1. Die Verbindung wirkt aufgrund ihrer Hydroperoxidgruppe stark oxidierend. PES ist aufgrund ihres Alkylrests etwas besser fettlöslich (lipophil) als Wasserstoffperoxid. Sie ist eine schwächere Säure als Essigsäure, ihre Salze können isoliert werden.
Die Dampfdruckfunktion ergibt sich nach August entsprechend lg(P) = −A/T+B (P in Torr, T in K) mit A = 2311 und B = 8,911 im Temperaturbereich von 0 °C bis 110 °C.
Peressigsäure bildet in Essigsäure oder Ethylacetat gelöst detonationsfähige Gemische. Diese Eigenschaft ist konzentrations- und temperaturabhängig.
| Detonationsfähigkeit von Peressigsäure in Essigsäure. | ||||||||||||
| Konzentration | in Ma% | 20 | 30 | 40 | 45 | 50 | 54 | 57 | ||||
| Temperatur | in °C | 112 | 97 | 81 | 70 | 58 | 40 | 20 | ||||
Verwendung
Die stark oxidierende Wirkung bedingt den Einsatz als Bleichmittel, unter anderem bei Papieren, Textilien und Stärke und als Desinfektionsmittel (in ca. einprozentiger Konzentration) und Sterilisationsmittel (z.B. bei der kaltaseptischen Abfüllung von Getränken in Kunststoffflaschen aus PET oder HDPE). Als chemisches Oxidationsmittel wird die Peroxyessigsäure auch zur Epoxidierung von Alkenen eingesetzt.
Sicherheitshinweise
Bei Mensch und Tier wirkt die Peroxyessigsäure stark haut- und augenreizend.
PES zersetzt sich selbstbeschleunigend und ist besonders gegen äußere Erhitzung und Verunreinigung empfindlich. Die exotherme Zersetzung führt zur Erhitzung der Flüssigkeit, die bis zum Aufkochen und Verpuffen führen kann. Die Gefahr nimmt mit der Konzentration und der Gebindegröße stark zu. Die Konzentration technisch eingesetzter Lösungen wird deshalb üblicherweise auf unter 15 % beschränkt.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 18.04. 2024



