
Uranylperoxid
| Sicherheitshinweise | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Radioaktiv | |||||||||
| |||||||||
Uranylperoxid ist eine chemische Verbindung von Uran und Sauerstoff und zählt zu den Peroxiden. Es ist in Form seines Hydrats im Mineral Studtit enthalten.
| Kristallstruktur | ||
|---|---|---|
| ||
| _ U6+ _ O2−, O− | ||
| Allgemeines | ||
| Name | Uranylperoxid | |
| Andere Namen |
Urandioxid-peroxid | |
| Verhältnisformel | UO4 | |
| Kurzbeschreibung | hellgelber Feststoff | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer | ||
| EG-Nummer | 234-852-1 | |
| ECHA-InfoCard | ||
| PubChem | ||
| ChemSpider | ||
| Eigenschaften | ||
| Molare Masse | 302 g/mol | |
| Aggregatzustand | fest | |
| Siedepunkt | Zersetzung > 200 °C | |
| Löslichkeit | schlecht löslich in Wasser | |
Darstellung
Allgemein kann Uranylperoxid aus einer Lösung von Uran(VI) durch Zugabe eines Peroxids, in der Regel Wasserstoffperoxidlösung, gewonnen werden. So wird aus einer siedenden Lösung von Uranylnitrat unter Zugabe von Wasserstoffperoxid und trocknen des Niederschlages das Dihydrat erhalten, während aus einer Lösung von Ammoniumuranyloxalat das Trihydrat gefällt wird.
Eigenschaften
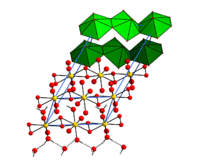
Kristallstruktur
Die Kristallstruktur des Tetrahydrates besteht aus UO22+-Ionen, an die zwei Wassermoleküle und zwei Peroxidionen O22− koordiniert sind. Die Peroxidionen fungieren hierbei als μ2-Liganden, die jeweils zwei Uranatome "edge-on" verbinden. Die zusätzlichen Kristallwassermoleküle sind durch Wasserstoffbrückenbindungen an die Uranylperoxidketten gebunden. Das Tetrahydrat ist bislang das einzige reine Uranylperoxid, das strukturell durch Röntgenbeugung charakterisiert wurde. Mithilfe der Dichtefunktionaltheorie konnte jedoch auch ein Strukturmodell für das Dihydrat erhalten werden, das gut mit früher veröffentlichten Röntgenbeugungsdaten übereinstimmt

Verwendung
In jüngerer Zeit ist auch die Synthese von Peroxouranaten gelungen, die komplexe Käfigstrukturen aufweisen, die in ihrer Topologie den Fullerenen gleichen. Diese können aus Uranylnitrat, Wasserstoffperoxid und einem Alkalihydroxid in wässriger Lösung gewonnen werden; in der Regel werden auch organische Moleküle – beispielsweise Amine – zugesetzt. Diese haben vermutlich eine Templatfunktion, ähnlich wie bei der Darstellung von Zeolithen. Auf Grund der Synthesebedingungen handelt es sich bei diesen Peroxouranverbindungen nicht um reine Uranylperoxide, da sie je nach Synthesemethode Fremdionen wie Li+ und organische Moleküle enthalten, die sich durch die bei der Strukturbestimmung verwendete Methode nicht immer nachweisen lassen.
Im System Kalium/Uranyl/Oxalat/Peroxid lassen sich durch Variation der Reaktionsbedingungen ähnliche Strukturen schrittweise aufbauen.
Die genauere Untersuchung des Uran/Peroxid-Systems in den letzten Jahren wird durch die Beobachtung motiviert, dass sich durch Radiolyse in wässriger Lösung Wasserstoffperoxid bilden kann und Kenntnisse über das chemische Verhalten von Uran und anderen Actinoiden in der Gegenwart von Peroxid für die Lagerung radioaktiven Abfalls relevant sind.
- Strukturen einiger Peroxouranate
-
![Peroxouranatcluster mit 50 Uranatomen[8]](bilder/120px-U50-nanosphere.png) Peroxouranatcluster mit 50 Uranatomen
Peroxouranatcluster mit 50 Uranatomen -
![Durch Peroxidbrücken gebildete Dimere aus Uranylionen in K6(H2O)4[(UO2)2(O2)(C2O4)4][9]](bilder/120px-UO2dimer.png) Durch Peroxidbrücken gebildete Dimere aus Uranylionen in K6(H2O)4[(UO2)2(O2)(C2O4)4][9]
Durch Peroxidbrücken gebildete Dimere aus Uranylionen in K6(H2O)4[(UO2)2(O2)(C2O4)4][9] -
![Pentagonale Oxalatoperoxouranatgruppe in K10[(UO2)(C2O4)]5(H2O)13[9]](bilder/120px-Uranylperoxidpentagon.png) Pentagonale Oxalatoperoxouranatgruppe in K10[(UO2)(C2O4)]5(H2O)13
Pentagonale Oxalatoperoxouranatgruppe in K10[(UO2)(C2O4)]5(H2O)13
Sicherheitshinweise
Wie alle Uranverbindungen, ist auch das Peroxid radioaktiv. Die spezifische Aktivität von frisch erzeugten Uranylperoxid aus irdischem Natururan beträgt 19930 Bq/g.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 14.10. 2023


