
Cobalt(II)-oxid
| Sicherheitshinweise | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| |||||||||
| Toxikologische Daten | 202 mg/kg (LD50, Ratte, oral)[3] | ||||||||
Cobalt(II)-oxid ist eines von mehreren Oxiden des chemischen Elementes Cobalt. Es ist ein olivgrünes, in Wasser unlösliches Salz.
| Kristallstruktur | ||
|---|---|---|
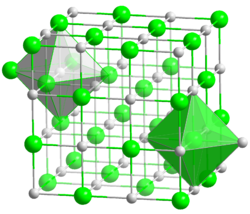
| ||
| _ Co2+ _ O2− | ||
| Allgemeines | ||
| Name | Cobalt(II)-oxid | |
| Andere Namen |
| |
| Verhältnisformel | CoO | |
| Kurzbeschreibung | olivgrüner Feststoff[1] | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer | | |
| EG-Nummer | 215-154-6 | |
| ECHA-InfoCard | | |
| PubChem | | |
| Eigenschaften | ||
| Molare Masse | 74,93 g/mol | |
| Aggregatzustand | fest | |
| Dichte | 5,7–6,7 g/cm3[1] | |
| Schmelzpunkt | 1935 °C[1] | |
| Löslichkeit | nahezu unlöslich in Wasser (3,13 mg/l)[1] | |
Gewinnung und Darstellung
Cobalt(II)-oxid entsteht, wenn elementares Cobalt an der Luft oder Cobalt(II)-nitrat, Cobalt(II)-hydroxid oder Cobalt(II)-carbonat unter Luftabschluss erhitzt werden.
Eigenschaften
Die Verbindung kristallisiert in der Natriumchlorid-Struktur, also im kubischen Kristallsystem in der Raumgruppe Fm3m (Raumgruppen-Nr. 225). Der Gitterparameter beträgt a = 424,9 pm, in der Elementarzelle befinden sich vier Formeleinheiten.[4] Meist kommt (ähnlich wie bei Eisen(II)-oxid FeO) ein leichter Cobalt-Unterschuss vor. Trocken ist Cobaltoxid beständig, feucht kann es leicht zu Cobaltoxidhydroxid CoO(OH) oxidiert werden. Unterhalb von 16 °C ist die Verbindung antiferromagnetisch.[5]
Wird es an der Luft auf 400–500 °C erhitzt, bildet sich Cobalt(II,III)-oxid.
Verwendung
Cobalt(II)-oxid wird als Rohstoff für die Herstellung von Pigmenten verwendet, insbesondere zur Herstellung des Pigments Smalte, das auch in der Keramikindustrie verwendet wird. Außerdem kann es zur Herstellung von Kobaltglas sowie von Thénards Blau (CoAl2O4) verwendet werden.
Literatur
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1.
- N. N. Greenwood, A. Earnshaw: Chemie der Elemente, 1. Auflage, VCH Verlagsgesellschaft, Weinheim 1988, ISBN 3-527-26169-9.
Einzelnachweise
- ↑ Hochspringen nach: a b c d
e f Eintrag zu
 Cobalt(II)-oxid
in der GESTIS-Stoffdatenbank des Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung, abgerufen am 11. November 2025. (JavaScript erforderlich)
Cobalt(II)-oxid
in der GESTIS-Stoffdatenbank des Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung, abgerufen am 11. November 2025. (JavaScript erforderlich)
- ↑ Eintrag zu
 Cobalt oxide
in der Datenbank ECHA CHEM der Europäischen Chemikalienagentur (ECHA), abgerufen am 11. November 2025. Hersteller bzw.
Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung
Cobalt oxide
in der Datenbank ECHA CHEM der Europäischen Chemikalienagentur (ECHA), abgerufen am 11. November 2025. Hersteller bzw.
Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung
 erweitern.
erweitern.
- ↑ G. J. A. Speijers, E. I. Krajnc, J. M. Berkvens, M. J. van Logten: Acute oral toxicity of inorganic cobalt compounds in rats.
In: Food and Chemical Toxicology. Band 20, Nr. 3,
Juni 1982, S. 311–314,
doi:
 10.1016/S0278-6915(82)80298-6.
10.1016/S0278-6915(82)80298-6.
- ↑ Jean D’Ans, Ellen Lax: Taschenbuch für Chemiker und Physiker. 3. Elemente, anorganische Verbindungen und Materialien, Minerale, Band 3. 4. Auflage, Springer, 1997,
ISBN 978-3-540-60035-0, S. 386 (
 eingeschränkte Vorschau in der Google-Buchsuche).
eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ P. S. Silinsky, M. S. Seehra: Principal magnetic susceptibilities and uniaxial stress experiments in CoO. In: Physical Review B, 24, 1981, S. 419–423;
doi:
 10.1103/PhysRevB.24.419.
10.1103/PhysRevB.24.419.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 11.11. 2025


