Magnesiumcarbonat
| Sicherheitshinweise | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| |||||||||
| MAK | Schweiz: 3 mg·m−3 (gemessen als alveolengängiger Staub) | ||||||||
Magnesiumcarbonat, MgCO3 ist eine anorganische chemische Verbindung.
Vorkommen
Magnesiumcarbonat kommt in der Natur in großen Mengen als Magnesit (Bitterspat) (MgCO3) mit der Härte 4–4½ vor. Es ist neben Dolomit das wichtigste Magnesium-Mineral. Ebenfalls bekannt sind die Minerale Barringtonit MgCO3·2 H2O, Nesquehonit (MgCO3·3 H2O) und Lansfordit MgCO3·5 H2O.
| Strukturformel | |
|---|---|
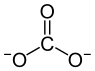 | |
| Allgemeines | |
| Name | Magnesiumcarbonat |
| Andere Namen |
|
| Summenformel | MgCO3 |
| Kurzbeschreibung | farbloser Feststoff |
| Externe Identifikatoren/Datenbanken | |
| CAS-Nummer |
|
| EG-Nummer | 208-915-9 |
| ECHA-InfoCard | 100.008.106 |
| PubChem | 11029 |
| DrugBank | DB09481 |
| Arzneistoffangaben | |
| ATC-Code |
|
| Eigenschaften | |
| Molare Masse | 84,31 g/mol |
| Aggregatzustand | fest |
| Dichte | 2,96 g/cm3 (20 °C) |
| Schmelzpunkt | > 350 °C (Zersetzung) |
| Löslichkeit | sehr schwer löslich in Wasser (0,106 g/l bei 20 °C) |
| Thermodynamische Eigenschaften | |
| ΔHf0 | −1095,8 kJ/mol |
Gewinnung und Darstellung
Magnesiumcarbonat fällt aus Magnesiumsalzlösungen mit Alkalimetallcarbonaten aus, jedoch nur bei Kohlendioxid-Überschuss. Anderenfalls entstehen basische Carbonate wie das „Magnesia alba“.
Amorphes kristallwasserfreies Magnesiumcarbonat, sogenanntes Upsalit, konnte erst jüngst durch eine Niedertemperatur-Synthese dargestellt werden und weist eine hohe spezifische Oberfläche von 800 m²/g MgCO3 auf. Bis dahin waren nur Synthesen bei erhöhter Temperatur bekannt, was in der Literatur als „Magnesit-Problem“ bekannt ist.
Eigenschaften
Das kristallwasserhaltige neutrale Magnesiumcarbonat geht, besonders in der Wärme, in basisches Magnesiumcarbonat über:
Magnesiumcarbonat ist zusammen mit Calciumcarbonat (Kalk) hauptsächlich für die Entstehung der Wasserhärte verantwortlich. Es kristallisiert trigonal, Raumgruppe R3c (Raumgruppen-Nr. 167), mit den Gitterparametern a = 4,637 Å und c = 15,02 Å.
Verwendung
Magnesiumcarbonat kommt als kristallwasserhaltiges 4 MgCO3 · Mg(OH)2 · 4–5 H2O als Magnesia alba, helle Magnesia, in den Handel (CAS-Nummer 12125-28-9). Eine wässrige Suspension von 50 g/l Wasser reagiert basisch und hat einen pH von etwa 10,5.
Lebensmittel
Magnesiumcarbonat ist Bestandteil von Mineral- und Heilwässern.
Adsorber
Wegen der großen spezifischen Oberfläche von 800 m²/g eignet sich Upsalit (kristallwasserfreies nano-Magnesiumcarbonat) als Adsorber für Entfeuchter und die Bindung von Öl auf Wasser. Auch eine Verwendung als Trägermaterial für Arzneimittelsubstanzen, bei der die Kontrollierbarkeit der Porengröße ausgenutzt wird, wird erforscht.
Lebensmittelzusatzstoff
In der Lebensmittelindustrie wird Magnesiumcarbonat Lebensmitteln als Säureregulator, Trägerstoff oder Trennmittel zugesetzt. Es gilt als gesundheitlich unbedenklich, große Mengen können jedoch abführend wirken.
In der Europäische Union ist es als Zusatzstoff mit der Nummer E 504 ohne Höchstmengenbeschränkung für alle Lebensmittel zugelassen, die Zusatzstoffe enthalten dürfen. Dies beinhaltet auch Bio-Produkte.
Isolier- und Füllstoff
Es wird in Wärmeisoliermaterialien verwendet und als Füllstoff in Kunststoffen, Papier, Farben und Kautschuk sowie in der Kosmetik in Pudern.
Arzneimittel
Zusammen mit Calciumcarbonat wird Magnesiumcarbonat in Medikamenten zur Magensäureregulation (Antazida) eingesetzt.
Sport
Magnesiumcarbonat wird von den Produzenten unter den Namen Magnesiumcarbonat, Magnesia oder Chalk vertrieben. Das Produkt verwenden Sportler um den auftretenden Handschweiß zu trocknen und damit die Griffigkeit der Hände bzw. die Gleitfähigkeit an den Geräteholmen zu erhöhen. Es ist in gepresster Blockform, als lockeres Pulver und neuerdings auch flüssig in Alkohol suspendiert erhältlich.
Feuerfest-Produkte
Vor allem in der Stahl- und Eisenindustrie (Stahlgießpfannen oder Elektroöfen), aber auch in der Zement- oder Glasindustrie (Auskleidung von Drehrohröfen oder Glasschmelzöfen) werden Feuerfestmaterialien aus Magnesit gefertigt. Das Magnesit wandelt sich bei Erhitzung unter Abgabe von Kohlendioxid in Magnesiumoxid um. Der weltweit größte und bedeutendste Hersteller ist die RHI AG (Radex Heraklith Industriebeteiligungs AG), die aus dem Veitsch-Radex-Konzern hervorging. Die Magnesitlagerstätten sind weltweit verteilt.
Magnesit ist ein Zuschlagstoff oder alleiniger Ausgangsstoff für technische Keramik, für feuerfeste Tiegel und Stäbchen. Hier wandelt sich das Magnesit beim Brennen in Magnesiumoxid-Keramik um oder es wird vorher gebrannt und als Magnesiumoxid in Pulverform eingesetzt.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 19.06. 2024

