
UDP-Glucose
| Sicherheitshinweise | |||
|---|---|---|---|
|
UDP-Glucose (Uridindiphosphat-Glucose) ist ein Nukleotidzucker, welcher nicht süß schmeckt. UDP-Glucose wird im Zuckerstoffwechsel als aktivierte Form von Glucose als Substrat von Glycosyltransferasen verwendet.
UDP-Glucose ist ein Produkt einer Phosphorsäureanhydrid-Austauschreaktion von Glucose-1-phosphat (G1P) und Uridintriphosphat (UTP).
Bildung
| Strukturformel | ||
|---|---|---|
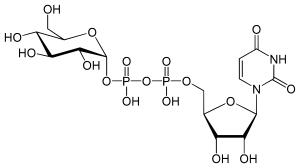
| ||
| Allgemeines | ||
| Name | UDP-Glucose | |
| Summenformel | C15H24N2O17P2 | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer | ||
| EG-Nummer | 205-121-4 | |
| ECHA-InfoCard | ||
| PubChem | ||
| ChemSpider | ||
| DrugBank | ||
| Eigenschaften | ||
| Molare Masse | 566,30 g/mol | |
Die Bildung von UDP-Glucose wird durch das Enzym UDP-Glucose-Phosphorylase katalysiert. Die Phosphatgruppe des G1P greift die α-Phosphatgruppe des UTP-Moleküls nucleophil an, wobei Pyrophosphat freigesetzt wird. Dieses wird anschließend von der Pyrophosphatase (anorganische Phosphatase) hydrolytisch zu zwei Phosphatmolekülen abgebaut. Durch die Hydrolyse des Pyrophosphats ist die Gesamtreaktion exergon:
G1P + UTP → UDP-Glc + PPi (ΔG°'= 0 kJ / mol)
PPi + H2O → 2 Pi (ΔG°' = −33,5 kJ / mol)
→ G1P + UTP + H2O → UDP-Glc + 2 Pi (ΔG°' = −33,5 kJ / mol)
Bedeutung im Stoffwechsel
UDP-Glucose ist der Baustein der Glycogensynthese und spielt somit eine wichtige Rolle im Glucosestoffwechsel. Unter Freisetzung von UDP wird an einen Glycogenstrang ein Glucosemolekül angehängt. Diese Reaktion wird von der Glycogensynthase katalysiert (ΔG°' = −13,4 kJ / mol). Für die Gesamtreaktion zur Verlängerung des Glycogenstrangs um ein Glucosemolekül (Glycogen (n Reste) + G1P + UTP → Glycogen (n+1 Reste) + UDP + 2 Pi) wird insgesamt ein Molekül UTP benötigt. Das entstehende UDP wird durch Reaktion mit ATP (katalysiert von der Nucleosiddiphosphatkinase) erneut zu UTP umgewandelt.
Siehe auch


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 02.09. 2025