
Peptidoglycane
Peptidoglycan (PGN), Peptidoglykan (pl. Peptidoglycane bzw. Peptidoglykane), auch Murein (aus dem Latein murus = Mauer, Wall, Schutz[1]), seltener Polysaccharid-Peptid genannt, ist ein aus Zuckern und Aminosäuren zusammengesetztes Makromolekül, das charakteristisch ist für die Zellwand (Murein-Sacculus) der Bakterien (Domäne Bacteria[2]).[3] Sowohl grampositive als auch gramnegative Bakterien besitzen in ihrer Zellwand eine Festigkeit verleihende Schicht aus einem Peptidoglycan. Die Dicke der Hülle ist unterschiedlich, bei grampositiven 20 bis 80 nm, bei gramnegativen weniger als 10 nm. Ausnahmen bilden die L-Formen von Bakterien und die zur Domäne der Bakterien zählenden Mycoplasmen und Spiroplasmen, die keine Zellwand und damit auch keine Mureinhülle besitzen, sowie die Planctomyceten,[4] die eine proteinreiche S-Layer-Zellwand aufweisen.
Das Fehlen von Peptidoglycan ist eines[5] der Definitionsmerkmale der Archaea (Domäne Archaea[2], früher Archaebakterien).[3] Bei einigen Archaeen, z. B. bei den Methanobacteriales und den Methanopyrales wurde das sog. Pseudopeptidoglycan (pseudomurein) gefunden und seine Biosynthese beschrieben.[6][7]
Peptidoglycan ist an der Zweiteilung (binary fission) der Bakterien beteiligt. Die zellwandlosen L-Formen von Bakterien und Mykoplasmen (früher als PPLOs – pleuropneumonia-like organisms bezeichnet) vermehren sich nicht durch Zweiteilung, sondern durch einen Knospungsmechanismus.[8][9]
Während der frühen Evolution der Organismen war die Abgrenzung der ersten Lebensstrukturen von der Umgebung (z. B. durch Membranen, Wände) die Voraussetzung für die Bildung von Zellen (Zellularisierung). Dabei war die Erfindung von festen Peptidoglycan-Zellwänden bei den Bakterien wohl die Grundlage für deren erfolgreiche Entwicklung, Ausbreitung und Besiedelung praktisch aller Habitate der Geosphäre und Hydrosphäre.[10][11]
Aufbau
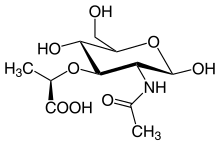
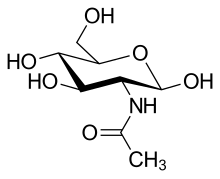
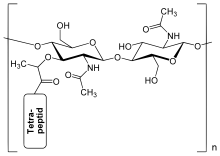
Peptidoglycan besteht aus Strängen der zwei β(1→4) glycosidisch miteinander verknüpften Zuckerderivatmoleküle N-Acetylglucosamin und N-Acetylmuraminsäure (siehe Bild 1), die als lineare Kettenmoleküle das Rückgrat bilden. Von jedem N-Acetylmuraminsäure-Molekül geht – an dessen Lactylgruppe gebunden – eine Oligopeptidkette zu einem N-Acetylmuraminsäure-Molekül eines benachbarten Stranges (siehe Bild 2). Die Zusammensetzung bei grampositiven wie auch gramnegativen Bakterien ist nicht immer einheitlich. So besitzen die meisten grampositiven Kokken statt Diaminopimelinsäure (DAP) L-Lysin. Manchmal ist die Aminosäure an Position 2 noch zusätzlich hydroxyliert.[12] Ein wichtiges Charakteristikum des Tetrapeptides ist das Vorhandensein von D-Aminosäuren wie D-Alanin bzw. D-Glutaminsäure, die enzymatisch durch Racemasen aus den entsprechenden L-Aminosäuren gebildet werden.
Vernetzung
Die parallel angeordneten Stränge sind quervernetzt. Für diese Verbindung wird ein Enzym benötigt, welches als Transpeptidase die Peptidketten miteinander verknüpfen kann. Diese Transpeptidase wird auch als Penicillin-bindendes Protein (PBP) bezeichnet, da sie der Angriffspunkt der Beta-Lactam-Antibiotika ist und so die Zellwandsynthese gehemmt wird. Sie kann unterschiedlich aufgebaut und deshalb resistent gegen diese Antibiotika sein.
Die peptidoglycanfreien L-Formen von Bakterien und die Mycoplasmen (Mollicutes) sind penicillinresistent, ebenso die peptidoglycanfreien Zellen der Eukaryoten (Domäne Eukarya[2]), also auch des Menschen.
Bei Escherichia coli und anderen gramnegativen Bakterien sind die beiden Tetrapeptide direkt verbunden (Abb. 2a). Hierbei ist die Aminogruppe der Diaminopimelinsäure des einen Peptids an die Carboxygruppe des terminalen D-Alanins des benachbarten Peptids verknüpft.
Bei Staphylococcus aureus bzw. grampositiven Bakterien verbindet eine Interpeptidbrücke aus fünf Glycinmolekülen (syn. Pentaglycinbrücke, Pentapeptidbrücke[13]) zwei Tetrapeptide (Abb. 2b).
Da das Verbindungsstück von Organismus zu Organismus verschiedene Aminosäuren enthalten kann, trägt dies dazu bei, dass über 100 unterschiedliche Arten von Peptidoglycanen bekannt sind.[12] Die Varianz der Aminosäuresequenz ist bei Grampositiven Bakterien stärker als bei Gramnegativen. Lediglich Histidin, Arginin oder Prolin wurden noch nicht in einem Verbindungsstück nachgewiesen. Die taxonomische Bedeutung der verschiedenen Peptidoglycan-Typen wurde beschrieben.[14]
Durch die Quervernetzung bildet das Murein ein flächiges Netz, das die Oberfläche der Bakterienzelle umspannt (Murein-Sacculus, siehe Abb. 3). In allen Fällen ist das Zuckerrückgrat gleich aufgebaut.
-
![Abb. 2a: Schematische Darstellung der Mureinschicht von gramnegativen Bakterien am Beispiel von Escherichia coli[12] MurNAc = N-Acetylmuraminsäure; GlcNAc = N-Acetylglucosamin; DAP = Diaminopimelinsäure](bilder/Peptidoglycan_E_coli.png) Abb. 2a: Schematische Darstellung der Mureinschicht von gramnegativen Bakterien am Beispiel von Escherichia coli[12]
Abb. 2a: Schematische Darstellung der Mureinschicht von gramnegativen Bakterien am Beispiel von Escherichia coli[12]
MurNAc = N-Acetylmuraminsäure;
GlcNAc = N-Acetylglucosamin;
DAP = Diaminopimelinsäure -
![Abb. 2b: Schematische Darstellung der Mureinschicht von grampositiven Bakterien am Beispiel von Staphylococcus aureus[12] MurNAc = N-Acetylmuraminsäure; GlcNAc = N-Acetylglucosamin](bilder/Peptidoglycan_S_aureus.png) Abb. 2b: Schematische Darstellung der Mureinschicht von grampositiven Bakterien am Beispiel von Staphylococcus aureus[12]
Abb. 2b: Schematische Darstellung der Mureinschicht von grampositiven Bakterien am Beispiel von Staphylococcus aureus[12]
MurNAc = N-Acetylmuraminsäure;
GlcNAc = N-Acetylglucosamin -
 Abb. 3: Schematische Darstellung der Mureinschicht (Peptidoglycan) von gramnegativen Bakterien
Abb. 3: Schematische Darstellung der Mureinschicht (Peptidoglycan) von gramnegativen Bakterien
Grampositive und gramnegative Bakterien
Ein Bakterium ist von einem einzigen Murein-Makromolekül umgeben. Gramnegative Bakterien (in der Gram-Färbung sich negativ verhaltend) besitzen eine dünne, einschichtige Mureinhülle, die etwa 5–10 % der Trockenmasse der Bakterienhülle ausmacht. Bei grampositiven Bakterien ist die dickere Zellwand aus einem mehrschichtigen Mureinnetz und Teichonsäuren aufgebaut. Der Mureinanteil kann hier bis zu 50 % der Trockenmasse der Bakterienhülle betragen, die durch basische Farbstoffe Gram-Färbung annimmt.[15]
Funktion, Erweiterung und Bedeutung
Die Mureinhülle hält den Bakterienprotoplasten gegen den osmotischen Innendruck zusammen. Wird die Mureinschicht verletzt oder aufgelöst, zum Beispiel durch das Enzym Lysozym, platzt das Bakterium. Beim Wachstum eines Bakteriums muss deshalb das Mureinnetz erweitert werden, ohne dass eine größere Lücke entsteht. Mureinbausteine werden im Cytoplasma synthetisiert und mit Hilfe des Lipidcarriers Bactoprenol (siehe auch: Transporter (Membranprotein)) exportiert. In dem außerhalb der Cytoplasmamembran gelegenen Mureinnetz werden durch spezifische lytische Enzyme lokal begrenzt Bindungen in den Rückgratsträngen und in den Oligopeptiden gelöst und die vorgefertigten und exportierten Mureinbausteine werden durch spezifische Enzyme eingefügt. Die Erweiterung des Mureins erfordert also ein genaues Zusammenspiel verschiedener Enzyme. Wird dieses Zusammenspiel gestört, platzt das Bakterium ebenfalls. Einige der wichtigsten Antibiotika, wie z. B. Vancomycin und Penicillin hemmen den Aufbau der Peptidoglycanschicht.
Rolle von Peptidoglycanen in der Darm-Hirn-Achse
Peptidoglycan spielt auch eine Rolle in der Darm-Hirn-Achse („gut-brain axis“) von Säugetieren. Der Magen-Darm-Trakt beherbergt verschiedene Mikroorganismen, darunter Bakterien, Archaeen, Pilze und Viren. Die Produkte des Stoffwechsels von Bakterien sind an den Stoffwechselfunktionen des Wirts beteiligt und beeinflussen außerdem das Immunsystem und das zentrale Nervensystem. Das Peptidoglycan wird von den Bakterien während des Zellwandabbaus und der Zellteilung sowie durch den Zelltod abgegeben. Bei einer Untersuchung an Mäusen wurde festgestellt, dass abgegebene Peptidoglycane die Aktivität der positiv auf den Appetit wirkende Neuronen im Hypothalamus direkt hemmen können. Dadurch wird das Hungergefühl und auch die Körpertemperatur herabgesetzt. Diese neue Erkenntnis könnte für die Behandlung von Stoffwechselstörungen wie Adipositas von Interesse sein.[16]
Einzelnachweise
- ↑ Wissenschaft-Online-Lexika: Eintrag zu Murein im
 Lexikon der Biologie.
Lexikon der Biologie.
- ↑ Hochspringen nach: a b c
Carl R. Woese, Otto Kandler, Mark L. Wheelis: Towards a natural system of organisms: Proposal of the domains Archaea, Bacteria and Eucarya.
In: Proceedings of the National Academy of Sciences.
Band 87,
Nr. 12, 1990,
S. 4576–4579,
doi:
 10.1073/pnas.87.12.4576,
10.1073/pnas.87.12.4576,
 PMID 2112744,
PMID 2112744,
 PMC 54159 (freier Volltext).
PMC 54159 (freier Volltext).
- ↑ Hochspringen nach: a b Michael T. Madigan, John M. Martinko, Kelly S. Bender, Daniel H. Buckley, David A. Stahl: Brock Biology of Microorganisms. 14. Auflage. Pearson Education Limited, Boston u. a. 2015, ISBN 978-1-292-01831-7, S. 66 ff.
- ↑ Wissenschaft-Online-Lexika: Eintrag zu Planctomycetales im
 Lexikon der Biologie.
Lexikon der Biologie.
- ↑ Otto Kandler, Hans Hippe: Lack of peptidoglycan in the cell walls of Methanosarcina
barkeri. In: Archives of Microbiology.
Band 113,
Nr. 1-2, Januar 1977,
S. 57–60,
doi:
 10.1007/BF00428580,
10.1007/BF00428580,
 PMID 889387.
PMID 889387.
- ↑ Helmut König, Otto Kandler, Walter Hammes: Biosynthesis of pseudomurein: isolation
of putative precursors from Methanobacterium thermoautotrophicum. In: Canadian Journal of Microbiology.
Band 35,
Nr. 1, 1989,
S. 176–181,
doi:
 10.1139/m89-027,
10.1139/m89-027,
 PMID 2720492.
PMID 2720492.
- ↑ Otto Kandler, Helmut König: Cell wall polymers in Archaea (Archaebacteria). In:
Cellular and Molecular Life Sciences. Band 54,
Nr. 4, 1998,
S. 305–308,
doi:
 10.1007/s000180050156,
10.1007/s000180050156,
 PMID 9614965.
PMID 9614965.
- ↑ Gertraud Kandler, Otto Kandler: Untersuchungen über die Morphologie und die
Vermehrung der pleuropneumonie-ähnlichen Organismen und der L-Phase der Bakterien. I. Lichtmikroskopische Untersuchungen. In: Archiv für
Mikrobiologie. Band 21,
Nr. 2, 1954,
S. 178–201,
doi:
 10.1007/BF01816378,
10.1007/BF01816378,
 PMID 14350641
(
PMID 14350641
( badw.de [PDF].
badw.de [PDF].
- ↑ M. Leaver, P. Domínguez-Cuevas, J. M. Coxhead, R. A. Daniel and Jeff Errington:
Life without a wall or division machine in Bacillus subtilis. In: Nature.
Band 457, 1. Februar 2009,
S. 849–853
(
 nature.com – Corrigendum: Band 460, Nr. 7254, 2009, S. 538).
nature.com – Corrigendum: Band 460, Nr. 7254, 2009, S. 538).
- ↑ Otto Kandler: The early diversification of life. In: Stefan Bengtson (Hrsg.): Early Life on Earth. Nobel Symposium 84. Columbia U.P., New York 1994, ISBN 978-0-231-08088-0, S. 152–160.
- ↑ Otto Kandler: The early diversification of life and the origin of the three domains:
A proposal. In: Jürgen Wiegel, Michael W.W. Adams (Hrsg.): Thermophiles: The keys to molecular evolution and the origin of life?
Taylor and Francis Ltd., London 1998, ISBN 0-203-48420-7, S. 19–31
(
 google.de).
google.de).
- ↑ Hochspringen nach: a b c d Michael T. Madigan und John M. Martinko: Brock Mikrobiologie. Pearson Studium; 11. aktualisierte Auflage 2009; ISBN 978-3-8273-7358-8; S. 83f.
- ↑ K. Aktories, U. Förstermann, F. Hofmann und K. Starke: Allgemeine und spezielle Pharmakologie und Toxikologie. 10. Auflage. München, Elsevier 2009. ISBN 978-3-437-42522-6.
- ↑ Karl-Heinz Schleifer, Otto Kandler: Peptidoglycan Types of Bacterial Bell Walls
and their Taxonomic Implications. In: Bacteriological Reviews.
Band 36,
Nr. 4, 1972,
S. 407–775,
doi:
 10.1128/MMBR.36.4.407-477.1972,
10.1128/MMBR.36.4.407-477.1972,
 PMID 4568761,
PMID 4568761,
 PMC 408328 (freier Volltext).
PMC 408328 (freier Volltext).
- ↑ Wissenschaft-Online-Lexika: Eintrag zu Murein im
 Lexikon der Biologie.
Lexikon der Biologie.
- ↑ Ilana Gabanyi, Gabriel Lepousez, Richard Wheeler, Alba Vieites-Prado, Antoine Nissant, Sébastien Wagner,
Carine Moigneu, Sophie Dulauroy, Samia Hicham, Bernadette Polomack, Florine Verny, Philip Rosenstiel, Nicolas Renier, Ivo Gomperts Boneca, Gérard Eberl, Pierre-Marie Lledo:
Bacterial sensing via neuronal Nod2 regulates appetite and body temperature In: Science Band 376, Ausgabe 6590 (2022).
doi:
 10.1126/science.abj3986
10.1126/science.abj3986


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 24.01. 2026