Indol
| Sicherheitshinweise | ||||||||
|---|---|---|---|---|---|---|---|---|
| ||||||||
| Toxikologische Daten | 1000 mg/kg (LD50, Ratte, oral)[2] | |||||||
Indol ist eine chemische Verbindung aus der Gruppe der aromatischen, heterocyclischen Amine und kommt als Substanz oder Strukturfragment in vielen Naturstoffen vor.
| Strukturformel | ||
|---|---|---|
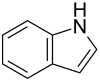
| ||
| Allgemeines | ||
| Name | Indol | |
| Andere Namen | ||
| Summenformel | C8H7N | |
| Kurzbeschreibung | farblose Blättchen, die rein einen blumenartigen und verunreinigt einen unangenehmen Geruch besitzen[2] | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer | ||
| EG-Nummer | 204-420-7 | |
| ECHA-InfoCard | ||
| PubChem | ||
| ChemSpider | ||
| DrugBank | ||
| Eigenschaften | ||
| Molare Masse | 117,15 g/mol−1 | |
| Aggregatzustand | fest[2] | |
| Dichte | 1,22 g/cm3 (20 °C)[3] | |
| Schmelzpunkt | 52 °C[3] | |
| Siedepunkt | 254 °C[3] | |
| Dampfdruck | 1,6 Pa (25 °C)[4] | |
| Löslichkeit | schwer in Wasser (3,56 g/l bei 25 °C)[3] | |
Geschichte
Die Indol-Chemie begann mit dem Studium des häufig verwendeten Farbstoffs Indigo. Indigo kann in Isatin und weiter zu Oxindol umgewandelt werden. 1866 reduzierte Adolf von Baeyer Oxindole mit Hilfe von Zinkstaub zu Indol.[5] 1869 schlug er eine Strukturformel für Indol vor.[6]
Bestimmte Indolderivate waren wichtige Farbstoffe bis zum Ende des 19. Jahrhunderts. In den 1930er-Jahren stieg das Interesse an Indol, als bekannt wurde, dass Indol Grundbestandteil vieler wichtiger Naturstoffe wie Alkaloide (zum Beispiel Strychnin und Auxin) und der Aminosäure Tryptophan und von ihr abgeleiteter Neurotransmitter (Serotonin, Melatonin) ist. Es bleibt ein aktiver Bereich der Forschung bis heute.[7]
Vorkommen
Indol ist im Jasminblütenöl,[8] Goldlacköl, aber auch in den Blüten der Gewöhnlichen Robinie,[8] der Gartenhyazinthe,[8] des Gemeinen Flieders,[9] der Strauß-Narzisse,[9] der falschen Akazie und im Aronstab enthalten. Indol ist in Süßholzwurzeln,[8] den Ölen von Jasmin, Neroli, Bitterorangen und Narcissus jonquilla,[10] den Blüten von Zitronen, Kaffee, Hevea brasiliensis und Randia Formosa,[10] in Gemüsekohl,[8] Aprikosen,[10] Trauben,[10] Kohlrabi,[10] Kartoffeln,[10] Sojabohnen,[10] Mais,[8] Tee,[8][10] Pilzen,[10] Reis,[10] Feigen,[10] den Schalen von Mandarinen[10] und verarbeiten Lebensmitteln, wie Käse,[10] Milch,[10] Fleisch,[10] Milchpulver,[10] Fischöl,[10] Buchweizen,[10] Bier,[10] Wein,[10] Rum[10] oder Lakritz[10] zu finden.
In höheren Konzentrationen ist Indol, als Abbauprodukt der Aminosäure Tryptophan, neben Skatol (3-Methylindol), Ursache für den typischen Gestank von Fäkalien. Es ist ebenfalls in der bei 240 bis 260 °C siedenden Steinkohlenteer-Fraktion enthalten.
Indol ist Teil der proteinogenen Aminosäure Tryptophan.
Darstellung
Indol oder Indolderivate lassen sich auf verschiedene Arten darstellen. So unter anderem durch:
- Fischersche Indolsynthese:
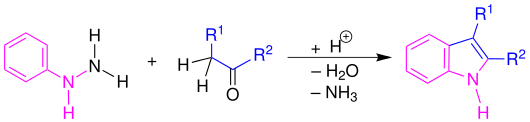
- Japp-Klingemann-Reaktion
- Bischler-Möhlau-Indolsynthese
- Larock-Indolsynthese
- Madelung-Indolsynthese
- Batcho-Leimgruber-Indol-Synthese
- Nenitzescu-Indolsynthese
- Gassman-Indol-Synthese
- Reissert-Indol-Synthese
- Fürstner-Indol-Synthese
Verwendung
Indol ist Grundbaustein für Farbstoffe, Hormone und Alkaloide. In geringen Konzentrationen vermittelt Indol den typischen Blütenduft und wird daher auch Parfüms zugesetzt. Die bekanntesten vom Indol abstammenden Farbstoffe sind das Indigo und der antike Farbstoff Purpur. Das Hormon Melatonin (N-Acetyl-5-methoxytryptamin), der Neurotransmitter Serotonin (5-Hydroxytryptamin) sowie das Auxin Indol-3-essigsäure enthalten Indol als Strukturelement. Unter den Alkaloiden, die Indol enthalten, seien die Strychnos-Alkaloide (z. B. Strychnin und Brucin), die Mutterkornalkaloide (Ergotamin und sein synthetisches Derivat LSD) sowie der Pilzinhaltsstoff Psilocybin genannt. Zudem wird es für die Herstellung künstlicher Jasmin- und Neroliöle verwendet.
Eigenschaften
Indol ist schwach basisch, bildet aber mit Säuren kaum Salze; stattdessen reagiert es leicht zu harzigen Polymeren. Durch Alkalimetalle wird das NH-Proton abstrahiert. Bei elektrophilen Reaktionen reagiert bevorzugt der Pyrrol-Ring. Indol inhibiert die Enzyme Chymotrypsin, Lysozym und Tryptophanase.
Nachweis
Der Indol-Test wird bei der Identifizierung von Bakterien verwendet. Hierzu gibt man einen Tropfen Dimethylaminobenzaldehyd (Ehrlich-Reagenz, Kovacs-Reagenz) in das MIO-Röhrchen der Bunten Reihe, das sich kirschrot verfärbt, wenn Tryptophan zu Indol abgebaut wurde.
Indolderivate
Es gibt zahlreiche Indolderivate, die in der Natur (Beispiel: Tryptophan), Technik (Beispiel: Indigo) und Pharmakologie (Beispiel: Indometacin) eine Rolle spielen.
Einzelnachweise
- ↑ Eintrag zu
 INDOLE in der
CosIng-Datenbank der EU-Kommission
INDOLE in der
CosIng-Datenbank der EU-Kommission
- ↑ Hochspringen nach: a b c Eintrag zu Indol. In: Römpp Online. Georg Thieme Verlag.
- ↑ Hochspringen nach: a b
c d e
f Eintrag zu
 Indol in der
GESTIS-Stoffdatenbank des Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung,
(JavaScript erforderlich)
Indol in der
GESTIS-Stoffdatenbank des Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung,
(JavaScript erforderlich)
- ↑
 Sicherheitsdatenblatt Indol. In: Fa. Merck KGaA.
Sicherheitsdatenblatt Indol. In: Fa. Merck KGaA.
- ↑ A. Baeyer: Ueber die Reduction aromatischer Verbindungen
mittelst Zinkstaub. In: Ann. 140. Jahrgang, 1866,
S. 295,
doi:
 10.1002/jlac.18661400306.
10.1002/jlac.18661400306.
- ↑ A. Baeyer, A. Emmerling: Synthese des Indols. In:
Chemische Berichte. 2. Jahrgang, 1869, S. 679,
doi:
 10.1002/cber.186900201268.
10.1002/cber.186900201268.
- ↑ R. B. Van Order, H. G. Lindwall: Indole.
In: Chem. Rev. 30. Jahrgang, 1942, S. 69–96,
doi:
 10.1021/cr60095a004.
10.1021/cr60095a004.
- ↑ Hochspringen nach: a b
c d e
f g
 INDOLE
In: Dr. Duke's Phytochemical and Ethnobotanical Database,
Hrsg. U.S. Department of Agriculture.
INDOLE
In: Dr. Duke's Phytochemical and Ethnobotanical Database,
Hrsg. U.S. Department of Agriculture.
- ↑ Hochspringen nach: a b
 INDOL
In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture.
INDOL
In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture.
- ↑ Hochspringen nach: a b
c d e
f g h
i j k
l m n
o p q
r s t
u v George A. Burdock:
Fenaroli's Handbook of Flavor Ingredients. CRC Press, 2004, ISBN 978-1-4200-3787-6,
S. 145
(
 eingeschränkte Vorschau in der Google-Buchsuche).
eingeschränkte Vorschau in der Google-Buchsuche).


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 19.06. 2025

