
Imide
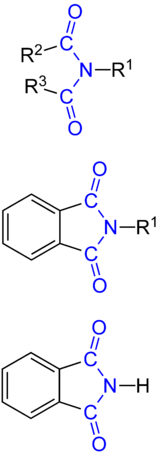
Imide (Imidoverbindungen) sind eine Stoffgruppe organischer Verbindungen mit der funktionellen Gruppe R–C(O)–NR–C(O)–R,. Es handelt sich somit um Carbonsäureamide mit zwei Acylgruppen am Stickstoff.
In der anorganischen Chemie werden Verbindungen, in denen die zweiwertige Gruppe =NH an ein Metall oder an andere Elemente wie Schwefel, Bor, Germanium oder Phosphor gebunden ist, als Metallimide (Beispiel Lithiumimid, Li2NH) bzw. Schwefelimide, Borimide, Phosphorimide usw. bezeichnet. Auch Imidobischwefelsäure (Imidosulfonsäure, (HSO3)2NH) zählt zu den Imiden.
Die organischen Verbindungen mit der Gruppe C=NH werden als Imine bezeichnet.
Struktur
Die Imidogruppe hat die Form: R2–C(O)–NR1–C(O)–R3, wobei C(O) jeweils eine Carbonylfunktion darstellt. R1, R2 und R3 sind beliebige organische Reste (wie Alkyl- oder Arylgruppen) oder Wasserstoffatome.
Chemie
Die Imidogruppe wird aus zwei Carbonsäuren (oder einer Dicarbonsäure) und aus Ammoniak oder einem primären Amin gebildet. Ein häufig verwendetes Imid ist Phthalimid, das aus Phthalsäure und Ammoniak aufgebaut wird. Falls der Rest R1 ein Wasserstoffatom ist (R1=H), besitzt die Imidogruppe aufgrund des starken −M-Effekts der beiden Carbonylgruppen im Falle einer Deprotonierung eine ausgeprägte Delokalisierungsmöglichkeit der negativen Ladung. Im Vergleich zur Amidogruppe (R1–CO–NR2R3) ist die Ladung somit nach der Deprotonierung besser stabilisiert und folglich die Säurestärke des Imids größer. Deshalb entsteht bei der Umsetzung von Phthalimid mit Kaliumhydroxid Phthalimid-Kalium, ein Salz, das in der Gabriel-Synthese als Nucleophil zur Herstellung von N-Organyl-Phthalimiden eingesetzt wird. Die N-Organyl-Phthalimide werden dann in primärere Amine umgewandelt, meist durch Hydrazinolyse (Erhitzen mit Hydrazin).


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 08.10. 2023