Extrinsische Leitfähigkeit
Extrinsische Leitfähigkeit bezeichnet den Anteil der Leitfähigkeit
eines Festkörpers, der durch den Einbau von Fremdatomen
in das Kristallgitter hervorgerufen wird.
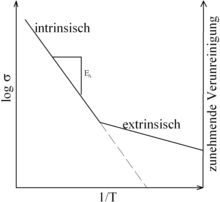
Das Einbringen von Fremdatomen wird Dotieren genannt. Diese Fremdatome bewirken eine Erhöhung der Leitfähigkeit, da sie – je nach Zahl ihrer Valenzelektronen – zusätzliche Leerstellen oder zusätzliche frei bewegliche Ladungen in den Festkörper einbringen.
Die extrinsische Leitfähigkeit ist bei tiefen Temperaturen nahezu temperaturunabhängig und besteht im Gegensatz zur intrinsischen Leitfähigkeit auch noch bei 0 K. Das hat zur Folge, dass die extrinsische Leitfähigkeit bei tiefen Temperaturen dominiert, während sie bei steigender Temperatur von der intrinsischen Leitfähigkeit überdeckt wird.
Der mathematische Zusammenhang ergibt sich aus der Arrheniusgleichung:
mit
- der Aktivierungsenergie
- der universellen Gaskonstante
- der Temperatur
- dem Faktor
für eine Bezugsgröße zu
In der Form
erhält man für diese Art von Festkörperleitfähigkeit geradlinige Arrheniusgraphen, deren Steigung proportional zur Aktivierungsenergie ist.
Da für intrinsische Gitterfehler eine thermische Anregung notwendig ist, ist die Aktivierungsenergie für intrinsische Leitung in der Regel doppelt so groß wie die der extrinsischen Leitung.[1] Je nach Dotierungsgrad erhält man für die extrinsische Leitung Geradenscharen mit verschiedenen Steigungen (nicht abgebildet).
Beispiel
Beim Dotieren von Kochsalz NaCl mit Mangan(II)-chlorid MnCl2 ändert sich die stöchiometrische Zusammensetzung der Verbindung je nach Dotierungsgrad:
L bezeichnet die Kationenleerstellen, die für die Erhaltung des Ladungsausgleichs notwendig sind.
Das Dotieren hat zur Folge, dass pro
Mn-Ion
eine Kationenleerstelle entsteht. Überschüssige
Cl
-Ionen
befinden sich wegen der Ladungsneutralität an einer anderen Stelle (z.B. Oberfläche) des Kristalls. Das Chlorid
kann sich nicht in der Nähe des Manganions – etwa auf einem Zwischengitterplatz – befinden,
da Zwischengitterplätze im NaCl-Gitter nicht von Chlorid besetzt werden können.
Einzelnachweise
- ↑ A. B. Lidiard: Ionic Conductivity. In: S. Flügge (Hrsg.): Electrical Conductivity II / Elektrische Leitungsphänomene II (= Handbuch der Physik). Band XX, Nr. 4. Springer, Berlin/Göttingen/Heidelberg 1957, S. 246–349, hier 280.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 21.11. 2024