Fructose-1,6-bisphosphatase
| Fructose-1,6-bisphosphatase | ||
|---|---|---|
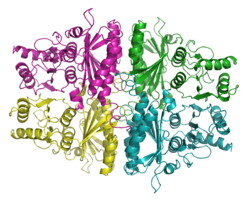
| ||
| Bändermodell des Tetramer nach
PDB
| ||
|
Vorhandene Strukturdaten:
| ||
| Masse/Länge Primärstruktur | 337 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Homotetramer | |
| Kofaktor | Zink | |
| Bezeichner | ||
| Gen-Name(n) |
| |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie |
| |
| Reaktionsart | Hydrolyse einer Phosphorsäureester-Bindung | |
| Substrat | D-Fructose-1,6-bisphosphat + H2O | |
| Produkte | D-Fructose-6-phosphat + Phosphat | |
| Vorkommen | ||
| Homologie-Familie |
| |
| Übergeordnetes Taxon | Lebewesen | |
Fructose-1,6-bisphosphatase (Abk.: FBPase) ist der Name des Enzyms, das Fructose-1,6-bisphosphat zu Fructose-6-phosphat abbaut. Es ist Bestandteil mehrerer Stoffwechselwege und in den meisten Organismen zu finden. Beim Menschen gibt es zwei Isoformen (Gene FBP1 und FBP2), die in der Leber und den Muskeln lokalisiert sind. Mutationen im FBP1-Gen können zum Mangel an FBPase führen.[1]
FBPase-1 ist hauptsächlich in Leber und Nieren lokalisiert, sowie im Ileum, in Leukozyten und im Gehirn. Obwohl sie im Urin relativ instabil ist, kann ihr Vorkommen dort als Marker für proximal tubuläre Nierenschäden verwendet werden.[2][3]
Katalysierte Reaktion
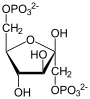 + H2O
+ H2O
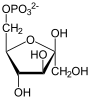 + Pi
+ Pi
Fructose-1,6-bisphosphat wird zu Fructose-6-phosphat und Phosphat hydrolysiert. Diese Reaktion ist Teil der Gluconeogenese und des Pentosephosphatwegs, sowie des Calvin-Zyklus der Pflanzen und des Dihydroxyacetonzyklus[4] in methylotrophen Lebewesen. Letztere können aus C1-Verbindungen wie Methanol, Methylamin oder Methyletherverbindungen Zellmaterial aufbauen.
Regulation
Während die Aktivität der FBPase durch Anwesenheit von Fructose-2,6-bisphosphat und AMP eingeschränkt wird, binden am Promoter des FBP1-Gens die Transkriptionsfaktoren USF1, Sp1 und NF-κB.[5]
Einzelnachweise
- ↑ UniProt
 P09467
P09467
- ↑ Kepka A, Szajda SD, Zwierz K:
[Fructose-1,6-bisphosphatase--marker of damage to proximal renal tubules]. In: Pol. Merkur.
Lekarski. 24. Jahrgang, Nr. 140, Februar 2008,
S. 125–30,
 PMID 18634268 (polnisch).
PMID 18634268 (polnisch).
- ↑
Kepka A, Dariusz Szajda S, Stypułkowska A,
et al: Urinary fructose-1,6-bisphosphatase activity as a marker of the damage to the renal proximal tubules in children with idiopathic
nephrotic syndrome. In: Clin. Chem. Lab. Med. 46. Jahrgang,
Nr. 6, 2008,
S. 831–5,
doi:
 10.1515/CCLM.2008.171,
10.1515/CCLM.2008.171,
 PMID 18601606.
PMID 18601606.
- ↑ Wolfgang Babel: Metabolische Zyklen – biochemisch notwendig und nützlich. In: BIOspektrum | 07.09 |
15. Jahrgang;
 PDF (freier Volltext)
PDF (freier Volltext)
- ↑ Herzog B, Waltner-Law M,
Scott DK, Eschrich K, Granner DK: Characterization of the human liver fructose-1,6-bisphosphatase gene promoter. In:
Biochem. J. 351 Pt 2. Jahrgang, Oktober 2000,
S. 385–92,
 PMID 11023824,
PMID 11023824,
 PMC 1221374 (freier Volltext) –
(
PMC 1221374 (freier Volltext) –
( biochemj.org).
biochemj.org).


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 14.06. 2025