
Deuterium
| Sicherheitshinweise | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
Deuterium (von griechisch δεύτερος deúteros, „der Zweite“) ist ein natürliches Isotop des Wasserstoffs. Sein Atomkern wird auch Deuteron genannt, er besteht aus einem Proton und einem Neutron (2H). Deuterium wird aufgrund seiner Masse auch als „Schwerer Wasserstoff“ bezeichnet. Es wurde 1931 von dem US-amerikanischen Chemiker Harold C. Urey entdeckt. Er erhielt dafür 1934 den Nobelpreis für Chemie.
Die beiden anderen Isotope des Wasserstoffs sind Protium (1H) und Tritium (3H).
Eigenständige Namen und Symbole für Isotope eines Elements gibt es nur bei Deuterium (Symbol D anstatt 2H) und Tritium (Symbol T anstatt 3H), weil das Massenverhältnis zwischen Protium und seinen Isotopen verhältnismäßig groß ist (Deuterium 1:2 und Tritium 1:3) und sich daraus merkliche Unterschiede im chemischen Verhalten ergeben. (Zum Vergleich: Bei dem nächstgrößeren Isotopenpaar 3He und 4He sind es 1:1,33; bei 235U und 238U nur noch 1:1,013).
| Strukturformel | |
|---|---|
| Allgemeines | |
| Name | Deuterium |
| Andere Namen |
|
| Summenformel | D2 (molekulare Form) |
| CAS-Nummer | 7782-39-0 |
| PubChem | 24523 |
| Kurzbeschreibung | farb- und geruchsloses Gas |
| Eigenschaften | |
| Molare Masse | 4,03 g/mol |
| Aggregatzustand | gasförmig |
| Dichte | 0,17 kg/m3 |
| Schmelzpunkt | −254,43 °C |
| Siedepunkt | −249,58 °C |
Beschreibung
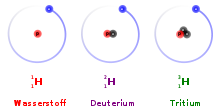
Das chemische Symbol ist 2H; aus Gründen der Vereinfachung in der Formelschreibweise wird häufig auch D verwendet.
Im Gegensatz zum 1H-Wasserstoff, dessen Atomkern nur aus einem einzigen Proton besteht, enthält der Deuteriumkern außer diesem Proton ein Neutron. Der Anteil an Deuterium in natürlich vorkommendem Wasserstoff beträgt 0,015 %.
Es wird davon ausgegangen, dass Deuterium allein in der primordialen Nukleosynthese unmittelbar nach dem Urknall entstanden ist, denn das bei der stellaren Nukleosynthese gebildete Deuterium fusioniert nach kurzer Zeit weiter zu Helium. Deshalb ist die Häufigkeit des Deuteriums im Kosmos ein wichtiger Parameter für kosmologische Modelle.
Chemisch verbinden sich im einfachsten Fall zwei Deuterium-Atome zu einem Deuterium-Molekül. Dabei gibt es je nach Gesamtspin IG des Moleküls zwei Varianten, das Orthodeuterium (o-D2), wenn das Kernspinisomer den Gesamtspin 0 oder 2 besitzt, und das Paradeuterium (p-D2) im Falle IG = 1.
Vorkommen
Die natürliche Häufigkeit des Isotops D beträgt 0,015 % von H. Das auf der Erde vorkommende Wasser (1,4 Milliarden Kubikkilometer oder 1,4 · 1018 t) besteht zu rd. einem Neuntel (2 von 18 u) oder rd. 11,1 % aus Wasserstoff (incl. Deuterium), demnach enthält es 0,000018 % oder 2,5 · 1013 t Deuterium.
Gewinnung
Deuterium lässt sich aufgrund des großen relativen Massenunterschieds leichter anreichern als die Isotope anderer Elemente wie z.B. Uran. In den ersten Anreicherungsstufen kommt gewöhnlich der Girdler-Sulfid-Prozess zum Einsatz. Dabei wird ausgenutzt, dass in einer wässrigen Schwefelwasserstoff-Lösung die Wasserstoffatome und die Deuteriumatome ihre Plätze zwischen beiden Molekülarten tauschen: Bei niedrigen Temperaturen wandert das Deuterium bevorzugt in das Wassermolekül, bei hohen Temperaturen in das Schwefelwasserstoffmolekül. In der letzten Anreicherungsstufe wird das Gemisch aus H2O, HDO und D2O durch Destillation getrennt.
Anwendungen

Eingesetzt wird Deuterium als Moderator in Kernreaktoren (hier in Form von schwerem Wasser), als Brennstoff in Wasserstoffbomben, als Ersatz für Protium (gewöhnlichen Wasserstoff) in Lösungsmitteln für die 1H-NMR-Spektroskopie und als Tracer in der Chemie und Biologie. Dort ist es ebenfalls in der NMR-Spektroskopie (insbesondere der Festkörper-NMR) ein wichtiges Isotopen-Label, um die Dynamik in organischen Substanzen zu detektieren und Strukturen aufzuklären. Ferner wird gasförmiges Deuterium in Speziallampen in Photometern eingesetzt, z.B. in der Atomspektroskopie als Quelle für UV-Licht.
Schweres Wasser

Ersetzt man beim Wasser (H2O) den Wasserstoff durch Deuterium, so erhält man Schweres Wasser (D2O). In Mischungen liegt durch den schnellen Austausch von Protonen und Deuteronen statistisch auch „halbschweres“ Wasser (HDO) vor.
Die Dichte von D2O beträgt 1,1047 g·cm−3 bei 25 °C, der Schmelzpunkt liegt bei 3,8 °C und der Siedepunkt bei 101,4 °C. Das Dichtemaximum liegt bei 11,2 °C (Wasser: 3,98 °C). Diese Unterschiede der physikalischen Eigenschaften gegenüber Wasser bezeichnet man als Isotopeneffekt. Er ist unter allen Nukliden zwischen 1H und 2H am stärksten ausgeprägt.
Schweres Wasser verlangsamt oder unterbindet viele Stoffwechselvorgänge, weswegen die meisten Lebewesen bei sehr hohem Deuteriumgehalt nur noch eingeschränkt lebensfähig sind.
- Schweres Wasser besitzt eine verminderte Lösefähigkeit im Vergleich zu normalem Wasser.
- Deuteronen haben ein geringeres Tunnelvermögen als Protonen und erschweren daher in biologischen Systemen die Aufrechterhaltung der elektrochemischen Gradienten an mitochondrialen Membranen. Diese sind aber ausschlaggebend für die Synthese von Adenosintriphosphat (ATP).
- Die Funktionsfähigkeit der meisten Proteine hängt von der Beweglichkeit der umgebenden Wassermoleküle ab. Da Deuteronen wegen der größeren Masse träger sind, können die Proteine ihre Aufgaben nur schlechter oder überhaupt nicht mehr erfüllen.
Sicherheitshinweise
Deuterium ist im GHS (früher: In der Richtlinie 67/548/EWG) nicht aufgeführt, ist aber in dieser Beziehung wie Wasserstoff zu betrachten, da sich alle Isotope eines Elements bezüglich ihres chemischen Verhaltens und ihrer Gefährlichkeit sehr ähnlich sind.


Datum der letzten Änderung: Jena, den: 05.11. 2021


