
Maillard-Reaktion



Die Maillard-Reaktion (benannt nach dem französischen Naturwissenschaftler Louis Camille Maillard [maˈjaʁ]) ist eine nicht-enzymatische Bräunungsreaktion, die beispielsweise beim Frittieren und Braten von Lebensmitteln zu beobachten ist. Hierbei werden Aminverbindungen (wie Aminosäuren, Peptide und Proteine) mit reduzierenden Verbindungen unter Hitzeeinwirkung zu neuen Verbindungen umgewandelt.[1] Sie ist nicht zu verwechseln mit dem Karamellisieren, jedoch können beide Reaktionen gemeinsam auftreten.
Anders als typischerweise von Namensreaktionen suggeriert, handelt es sich hier nicht um eine einzelne bestimmte chemische Reaktion, sondern um eine komplexe Gesamtheit vieler sowohl nebeneinander wie auch nacheinander ablaufender Reaktionen, die zu einer Vielzahl von Reaktionsprodukten führt, von denen viele bis heute noch nicht exakt identifiziert wurden.
Geschichte
1912 veröffentlichte Louis Camille Maillard eine wissenschaftliche Arbeit, die die Reaktion von Aminosäuren mit Glykosiden bei erhöhten Temperaturen beschrieb.[2][3] Es war jedoch der amerikanische Chemiker John E. Hodge, der am U.S. Department of Agriculture in Peoria, Illinois arbeitete und 1953 ein Dokument veröffentlichte, das den Reaktionsmechanismus der Maillard-Reaktion beschreibt.[4][5]
Chemische Grundlagen
Die Maillard-Reaktion ist von Bedeutung für das Kochen und die Lebensmittelindustrie, denn die braunen, Melanoidine genannten Endprodukte sind geschmacksintensiv und für das typische Aroma und die Färbung von Geröstetem, Gebackenem und Gebratenem mit hohem Eiweißanteil verantwortlich. Die Reaktion verzögert auch den Verderb, da die Melanoidine wie das Pronyl-Lysin Luftsauerstoff binden. Wissenschaftler ermittelten außerdem eine schwach antibakterielle Wirkung.[6] Die Maillard-Reaktion kann aber auch unerwünschte Geschmacksveränderungen beim Sterilisieren von beispielsweise Fleisch oder Milchprodukten hervorrufen und selbst ohne Hitzeeinwirkung bei langer Lagerung proteinhaltiger Lebensmittel auftreten. Durch die Maillard-Reaktion kann sich der Aminosäuregehalt von Lebensmitteln bis zu 20 % verringern, was man als eine Wertminderung ansehen kann.
In der mehrstufigen Reaktion wird ab etwa 140 °C zuerst unter Abspaltung von Wasser eine Aminosäure mit reduzierenden Zuckern wie Aldosen (z. B. Glucose) oder Acyloinen (z. B. Fructose) verbunden. Es entsteht eine Schiffsche Base, die sich in mehreren Schritten umlagert. Bei einer Reaktion mit Aldosen erfolgt eine Amadori-Umlagerung, bei Acyloinen eine Heyns-Umlagerung. Es entstehen aus den Amadori- und Heyns-Produkten hochreaktive Alpha-Dicarbonylverbindungen wie die als Deoxyosone bezeichneten 1-, 3- und 4-Deoxydicarbonyle und daraus viele weitere. Teilweise entstehen cyclische Verbindungen und heterocyclische Verbindungen. Die 1-Deoxyosone können z. B. zu Norfuraneol (Karamellgeruch) oder Maltol (Röstgeruch) reagieren, während aus den 3-Deoxyosonen z. B. Furfural (aus Pentosen) oder 5-Hydroxymethylfurfural (aus Hexosen) und aus 4-Deoxyosonen z. B. Maltol oder Acetylformoin gebildet werden. Durch weitere Reaktionen mit Aminverbindungen entstehen z. B. Pyrrole und Pyridine.
Auch entstehen durch einen Strecker-Abbau geruchsintensive Aldehyde wie Methional, Phenylacetaldehyd, 3- und 2-Methylbutanal und 3- und 2-Methylpropanal sowie Melanoidine.[1] Weiterhin entstehen mit der Aminosäure Cystein schwefelhaltige cyclische Reaktionsprodukte charakteristischen Geruchs, z. B. Bis-2-methyl-3-furyldisulfid.[7] Unter den für eine Maillard-Reaktion förderlichen Bedingungen einer wasserfreien Hitze läuft parallel zur Maillard-Reaktion auch die Karamellisierung der im Gargut enthaltenen Kohlenhydrate ab.[7] Ab 180 °C beginnen auch Verkohlungsprozesse.[7]
Entstehung von Acrylamid
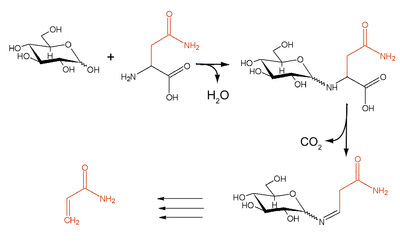
Beispiel einer unerwünschten Maillard-Reaktion ist die bei Temperaturen ab 170–190 °C verstärkt stattfindende Bildung von Acrylamid aus den Aminosäuren Asparagin und Glutamin[8] (etwa in Kartoffel- und Getreideprodukten). Durch geregelte Temperaturführung unter der kritischen Temperatur kann diese Reaktion vermindert werden. Eine Reduktion der Acrylamid-Entstehung bei Kartoffeln ist auch durch deren dunkle und kühle (6–10 °C) Lagerung sowie die Verwendung bereits gekochter Kartoffeln möglich.[9][10]
Unerwünschte Maillard-Reaktionen führen zu zahlreichen weiteren, potenziell mutagen oder karzinogen wirkenden Verbindungen. Die Zusammenhänge sind teilweise noch ungeklärt.
In der Lebensmittelherstellung
Die Maillard-Reaktion beeinflusst Geschmack, Konsistenz und Geruch vieler Lebensmittel, dazu gehören zum Beispiel:
- Röstprodukte wie Kaffeebohnen, Kakaobohnen, Malz oder Zwiebeln
- pflanzlicher Fleischersatz[11]
- frittierte Lebensmittel wie Pommes frites
- Backwaren wie Brot, Toast oder Kekse
- gebratene Speisen wie Steak
Viele Aromen werden mit Hilfe der Maillard-Reaktion industriell hergestellt (Reaktionsaromen). Aus unterschiedlichen Aminosäuren und Zuckerarten werden in Kombination von Wärmedauer sowie Erwärmungsart die verschiedensten Aromen hergestellt. So bildet die Kombination der Aminosäure Cystein mit dem Zucker Glukose bei langer Erwärmung das Aroma von Bratzwiebeln, bei kurzer Erwärmungsdauer das Aroma von Braten.[12]
Beeinflussung der Maillard-Reaktion
Einfluss auf die Maillard-Reaktion (Bildungsgeschwindigkeit, Anteil Maillard-Verbindungen im Endprodukt) haben bei der Lebensmittelherstellung eine Reihe von Faktoren. Eine Verringerung des Wasseranteils, sowie eine Erhöhung des Proteinanteils, der reduzierenden Zucker, der thermischen Energie, des pH-Werts und/oder der Zeit der Reaktion wirken dabei förderlich für die Maillard-Reaktion.
Beispiele zur Anwendung:
- Erhöhung des pH-Werts durch Lauge bei der Herstellung von Laugengebäck.
- Senkung des Wasseranteils in der Brotkruste durch trockene Hitze.
- Bestreichen von Keksen oder Brötchen mit Eiklar oder Zuckerlösung vor dem Backen.[13]
Medizinische Aspekte
Die Maillard-Reaktion spielt eine Rolle in gewissen Alterungsprozessen im menschlichen Körper und beim Diabetes mellitus.[14][15] Hierbei führen oxidative Reaktionen zu Schädigungen am Körpergewebe. Im Sommer 2004 wurden auf einer Hamburger Konferenz jedoch überraschende Zwischenergebnisse einer EU-Studie (seit 1998) vorgestellt, welche auch antioxidative Wirkungen der Maillard-Produkte belegen. Eine Gruppe italienischer Wissenschaftler um Vincenzo Fogliano von der Universität Neapel entdeckte darüber hinaus, dass Melanoidine einer Entstehung von Metastasen entgegenwirken können.[16][17]
Die im Labor erzeugten Maillard-Produkte blockieren bestimmte Proteine, die Lektine,[18] die den Zusammenhalt von Krebszellen bewirken und damit die Metastasenbildung beschleunigen. Andererseits weisen Patienten mit Diabetes oder Nierenfunktionsstörungen einen erhöhten Melanoidinspiegel auf. Hier sind die genauen Zusammenhänge noch ungeklärt.
Literatur
- Michael Angrick, Dieter Rewicki: Die Maillard-Reaktion. In: Chemie in unserer Zeit. 14. Jahrg., Nr. 5, 1980, S. 149–157;
 doi:10.1002/ciuz.19800140503.
doi:10.1002/ciuz.19800140503. - Franz Ledl, Erwin Schleicher: Die Maillard-Reaktion in Lebensmitteln und im menschlichen Körper – neue Ergebnisse zu Chemie, Biochemie
und Medizin. In: Angewandte Chemie.
Band 102,
Nr. 6, 1990,
S. 597–626,
doi:
 10.1002/ange.19901020604.
10.1002/ange.19901020604. - Monika Pischetsrieder: Die Maillard-Reaktion von Disacchariden und Polysacchariden und Reaktionen von Glucose in konzentrierten Lösungen. München 1994.
- Bernd Schäfer: Naturstoffe in der chemischen Industrie. Spektrum Akademischer Verlag, 2007, ISBN 978-3-8274-1614-8, S. 168–173.
Einzelnachweise
- ↑ Hochspringen nach: a b Hans-Dieter Belitz, Werner Grosch, Peter Schieberle: Food chemistry. Springer, Berlin 2009, ISBN 978-3-540-69935-4, S. 270–289.
- ↑ Louis Camille Maillard: Formation of Melanoidins in a Methodical Way. In: Compt. Rend. Band 154, 1912, S. 66 (englisch).
- ↑ C. O. Chichester (Hrsg.): Advances in Food Research – Advances in Food and Nutrition Research. Band 30. Academic Press, Boston 1986, ISBN 0-12-016430-2, S. 79 (englisch).
- ↑ J. E. Hodge:
Dehydrated Foods, Chemistry of Browning Reactions in Model Systems. In:
Journal of Agricultural and Food Chemistry.
Band 1,
Nr. 15, 1953,
S. 928–943,
doi:
 10.1021/jf60015a004 (englisch).
10.1021/jf60015a004 (englisch).
- ↑ Sarah Everts:
The Maillard Reaction Turns 100. In:
Chemical & Engineering News.
Band 90,
Nr. 40, 1. Oktober 2012,
S. 58–60 (englisch,
 acs.org).
acs.org).
- ↑ Shigeru Hiramoto et al.: Melanoidin, a food protein-derived advanced maillard reaction product,
suppresses Helicobacter pylori in vitro and in vivo. In: Helicobacter. Band 9, Nr. 5, Okt 2004, S. 429–435.
 PMID 15361082.
PMID 15361082.
- ↑ Hochspringen nach: a b c Nathan Myhrvold, Chris Young, Maxime Bilet: Modernist Cuisine: The Art and Science of Cooking. Band 3, The Cooking Lab, 2011, ISBN 978-0-9827610-0-7, S. 89ff.
- ↑ Eintrag zu Maillard-Reaktion. In: Römpp Online. Georg Thieme Verlag.
- ↑ Eintrag zu Acrylamid. In: Römpp Online. Georg Thieme Verlag.
- ↑
 Einflussfaktoren auf Ertrag und Inhaltsstoffe
der Kartoffel. Landesamt für Umwelt, Landwirtschaft und Geologie Sachsen (PDF); Internet Archive
Einflussfaktoren auf Ertrag und Inhaltsstoffe
der Kartoffel. Landesamt für Umwelt, Landwirtschaft und Geologie Sachsen (PDF); Internet Archive
- ↑ A. Sun, W. Wu, Op Soladoye, Re Aluko, Kh Bak: Maillard reaction of
food-derived peptides as a potential route to generate meat flavor compounds: A review. In: Food research international (Ottawa,
Ont.). Band 151, Januar 2022,
ISSN 1873-7145,
doi:
 10.1016/j.foodres.2021.110823,
10.1016/j.foodres.2021.110823,
 PMID 34980374.
PMID 34980374.
- ↑ Patricia Ziegler:
 Happy Birthday
Maillard Reaktion! Lebensmittelfokus.at, Internet Archive
Happy Birthday
Maillard Reaktion! Lebensmittelfokus.at, Internet Archive
- ↑ Patricia Ziegler:
 Das „Schnelle Zwiebel“ Experiment.
Lebensmittelfokus.at, Internet Archive
Das „Schnelle Zwiebel“ Experiment.
Lebensmittelfokus.at, Internet Archive
- ↑ Ralf Liedke: Bildung von Dicarbonylverbindungen beim Abbau von Amadori-Umlagerungsprodukten.
Inaugural-Dissertation. 1999, S. 1–16.
 (lebensmittelchemie.liedke.de)
(lebensmittelchemie.liedke.de)
- ↑ E. Schleicher: Die Bedeutung der Maillard-Reaktion in der menschlichen
Physiologie. In: Zeitschrift für Ernährungswissenschaft.
Band 30,
Nr. 1, 1. Februar 1991,
ISSN 1435-1293, S. 18–28,
doi:
 10.1007/BF01910729
(
10.1007/BF01910729
(  springer.com).
springer.com).
- ↑
 Vincenzo
Fogliano:Biochimica degli alimenti. (vom 10. Mai 2006 im Internet Archive; PDF) ital.
Vincenzo
Fogliano:Biochimica degli alimenti. (vom 10. Mai 2006 im Internet Archive; PDF) ital.
- ↑
 Caffé e antiossidanti: i segreti per una buona salute nascosti in una tazzina? Encanta.it
Caffé e antiossidanti: i segreti per una buona salute nascosti in una tazzina? Encanta.it
- ↑ Uta Bilow:
 Ist die Bratwurst gesünder als ihr Ruf?
In: Frankfurter Allgemeine Zeitung. 29. September 2004.
Ist die Bratwurst gesünder als ihr Ruf?
In: Frankfurter Allgemeine Zeitung. 29. September 2004.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 08.12. 2024