Tollensprobe

Die Tollensprobe (benannt nach dem Agrikulturchemiker Bernhard Tollens) oder Silberspiegelprobe ist ein Nachweis für Aldehyde bzw. reduzierende funktionelle Gruppen. Die Herstellung des Reagenzes wurde im Jahr 1881 erstmals durch Bernhard Tollens beschrieben.[1][2]
Das Tollensreagenz ist eine ammoniakalische Silbernitrat-Lösung, welche man herstellt, indem man zu einer Silbernitrat-Lösung so lange konzentrierte Ammoniak-Lösung hinzutropft, bis der entstehende braune Niederschlag von Silber(I)-oxid (Ag2O) in den löslichen Diamminsilber(I)-komplex ([Ag(NH3)2]+) übergeht.[3]
Zum Nachweis gibt man zu einer wässrigen Lösung der zu testenden Substanz im Reagenzglas die ammoniakalische Silbernitrat-Lösung und erwärmt diese im Wasserbad für wenige Minuten auf ca. 70 °C.
Der Nachweis ist positiv, wenn sich durch Fällung von elementarem Silber die Lösung schwarz verfärbt und sich an der Innenwand des Reagenzglases Silber abscheidet, was zur Bildung eines spiegelnden Belages führt.
Die Reaktionsgleichung für die Oxidation von Ethanal (Acetaldehyd) als Beispiel für einen reduzierenden Stoff mit ammoniakalischer Silbernitrat-Lösung zu Essigsäure lautet:
Mit der Tollensprobe lassen sich auch leicht die Aldehydgruppen reduzierender Zucker wie Glucose oder Lactose nachweisen. Obwohl die offenkettige Form (Aldehyd) dieser Zucker in wässriger Lösung nur in sehr geringem Anteil neben den geschlossenen Ringformen (hier ist die Aldehydgruppe als Halbacetal gebunden) vorliegt, läuft die Reaktion dennoch praktisch vollständig ab, da die offenkettige Form über ein chemisches Gleichgewicht aus den Ringformen nachgebildet wird.
z. B.:
Die ammoniakalische Silbernitrat-Lösung muss immer frisch hergestellt werden, weil sich bei längerem Stehen das hochexplosive Silbernitrid Ag3N abscheiden würde.[5]
Die Tollensprobe – eine Redoxreaktion
Da die Oxidation der Probesubstanz durch Reduktion der Silber(I)-Ionen erfolgt, kann die Gesamtreaktion wie bei allen Redoxreaktionen in eine Oxidations- und Reduktionsreaktion zerlegt werden. Dabei wird im nachfolgenden Beispiel zur Vereinfachung nicht berücksichtigt, dass die Silberionen eigentlich in einem Silberdiamminkomplex vorliegen:
Die Redox-Reaktion lässt sich auch (hier am Kohlenstoff-Atom) mit Hilfe der Oxidationszahlen verfolgen:
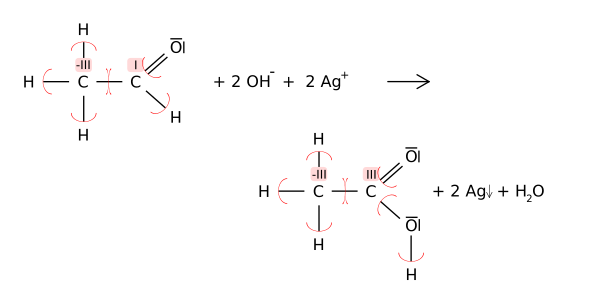
Da die Reaktion im alkalischen Milieu stattfindet, wird die entstehende Carboxygruppe (im Beispiel die Carboxygruppe der Essigsäure) durch Hydroxidionen zur Carboxylatgruppe im Sinne einer Säure-Base-Reaktion deprotoniert. Es entsteht im Beispiel das Acetat:
Weitere Nachweisreaktionen für Aldehyde:
- Fehling-Probe
- Schiffsche Probe mit dem Schiffschen Reagenz
- Benedict-Reagenz
Einzelnachweise
- ↑ B. Tollens: Notiz über einige Aldehyd- und Jodoformreaktionen in Berichte der deutschen Chemischen Gesellschaft 14 (1881) 1950f.
- ↑ Rolf Werner Soukup: Chemiegeschichtliche Daten anorganischer Substanzen,
Version 2020, S. 45
 pdf.
pdf.
- ↑ B. Tollens: Ueber ammon-alkalische Silberlösung als
Reagens auf Aldehyd. In: Berichte der Deutschen Chemischen Gesellschaft. 15. Jahrgang, 1882,
S. 1635–1639
(
 hathitrust.org).
hathitrust.org).
- ↑
 Unterscheidung von Aldehyden und Ketonen
Unterscheidung von Aldehyden und Ketonen
- ↑
 Prof. Blumes Tipp des Monats Dezember 2000
Prof. Blumes Tipp des Monats Dezember 2000


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 11.08. 2024