
Porine
| Porine | ||
|---|---|---|
| ||
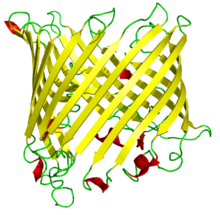
| Schematische Darstellung eines Sucrose spezifischen Porins aus Salmonellen: Seitenansicht (parallel zur Membran) der β-Fass-Struktur mit den antiparallelen β-Faltblättern im Bändermodell für das Monomer. | ||
| Masse/Länge Primärstruktur | 300–420 Aminosäuren | |
| Transporter-Klassifikation | ||
| TCDB |
| |
| Bezeichnung | Β-Fass-Porine | |
| Vorkommen | ||
| Übergeordnetes Taxon | Mitochondrien, Plastiden, Bakterien | |
| Ausnahmen | manche gram-positive Bakterien | |
Porine sind porenformende, unspezifische Transmembranproteine in der äußeren Membran von gramnegativen Bakterien, Chloroplasten und Mitochondrien. Sie dienen dem Stoffaustausch durch die Membran hindurch.
Sie wurden entdeckt und benannt von Hiroshi Nikaidō.
Es herrscht bei allen Porinen ein übereinstimmendes Konstruktionsprinzip vor: Sie bestehen aus einer Kette von 300–420 Aminosäuren, die zu einem 16- oder 18-strängigen antiparallelen β-Fass gefaltet ist (16 oder 18 Stränge bilden ein β-Faltblatt). Die Wandung der Pore ist sehr dünn; sie besitzt nur die Stärke einer Aminosäure. Im Innern des Porins befindet sich eine Engstelle mit einigen ionisierbaren Aminosäuren, an der die Durchlasseigenschaften der Pore festgelegt werden.
Wenn man die Porine unterschiedlicher Arten untersucht, stellt man fest, dass sie sich in etlichen Strukturmerkmalen ähneln. Dies deutet auf Homologie und kann als Beleg dafür herangezogen werden, dass es sich bei den Porinen um sehr konservative Proteine handelt, die sich im Verlauf der Evolution nur wenig verändert haben.
Mitochondriales Porin (Ø ~4 nm) liegt in der äußeren mitochondrialen Membran und ermöglicht die freie Diffusion von Molekülen bis etwa 5000 Da. Es wird auch als VDAC (voltage-dependent anion channel) bezeichnet, da es den geregelten Durchtritt von anionischen Molekülen wie Chlorid, Phosphat oder Nukleotiden erlaubt.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 14.12. 2023