Chlorate
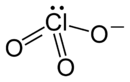
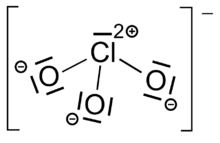
Chlorate sind Salze der Chlorsäure HClO3. Sie enthalten als Anion das Chlorat-Ion (ClO3−). Chlor weist dabei die Oxidationszahl +5 auf. Wichtige Chlorate sind Natriumchlorat, Aluminiumchlorat und Kaliumchlorat.
Die meisten Chlorate sind starke und spontan reagierende Oxidationsmittel. Gemische von Chloraten mit Reduktionsmitteln wurden früher auch als Explosivstoffe und Zündmittel () verwendet. Heute werden sie hierzu wegen ihrer Reibungsempfindlichkeit und der Tendenz zur Spontanreaktion nicht mehr eingesetzt.
Bindungsstruktur
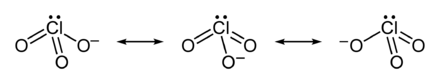
Durch die Lewisschreibweise wird meist nur eine mesomere Grenzstruktur des Chlorat-Ions dargestellt. Tatsächlich sind alle Cl-O Bindungen identisch, was durch die gleiche Länge aller Bindungen zum Ausdruck kommt (für Kaliumchlorat beispielsweise 1.49 Å
Siehe auch


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 07.03. 2025