Chloroxide
Chloroxide sind chemische Verbindungen zwischen dem Halogen Chlor und Sauerstoff. Seinen Oxidationsstufen entsprechend bildet Chlor eine Reihe von Oxiden, die im Allgemeinen und besonders unter Erwärmen leicht zerfallen. In Gegenwart oxidierbarer Materie neigen Chloroxide zu Explosionen, sie sind allesamt instabile Verbindungen und daher sehr reaktionsfähig und starke Oxidationsmittel.
Übersicht
| Oxidationszahl | |||||||
| I | II | III | IV | V | VI | VII | |
| ClOx | ClO | ClO2 | ClO3 | ||||
| Cl2Oy | Cl2O | Cl2O2 | Cl2O3 | Cl2O4 | Cl2O5* | Cl2O6 | Cl2O7 |
* Dichlorpentaoxid (Cl2O5) ist bisher unbekannt.
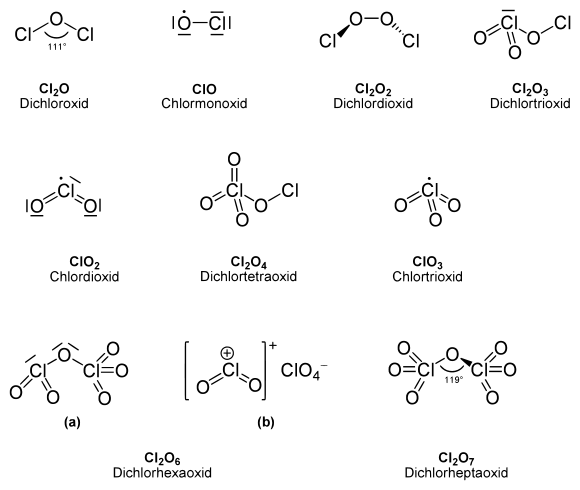
Eigenschaften
Chlordioxid
Technisch wichtig ist nur Chlordioxid (ClO2). Es ist bei Standardtemperatur ein gelb-rötliches Gas mit einer molaren Masse von 67,46 g/mol. Beim Erwärmen zerfällt es explosionsartig in Cl2 und O2.
Dichloroxid
Dichloroxid (Dichlormonoxid, Cl2O) ist ein gelbbraunes Gas mit einer Molmasse von 86,91 g/mol. Bei Standardtemperatur hat es eine Dichte von 3,89 g/l. Dichlormonoxid gefriert bei −116 °C, siedet bei 4 °C und ist explosiv. Dichloroxid ist das Anhydrid der Hypochlorigen Säure.
Cl2O kann durch Überleiten von Chlor über frisches Quecksilber(II)-oxid erhalten werden:
Chlormonoxid
Chlormonoxid (ClO), ein Radikal, spielt eine wichtige Rolle bei der Entstehung des Ozonlochs in der Stratosphäre, wenn Chlor vorhanden ist. Es bildet sich beispielsweise durch Photolyse oder Mikrowellenentladung von Chlor/Sauerstoff-Gemischen. Alternativ kann es aus der Reaktion elementaren Chlors mit Ozon bzw. Dichlormonoxid entstehen.
Dichlordioxid
Dichlordioxid (Cl2O2, Dichlorperoxid, manchmal als Chlorperoxid bezeichnet) entsteht durch Dimerisierung zweier Chlormonoxidradikale gemäß:
Thermisch zerfällt es in Chlor und Sauerstoff, photochemisch u. a. in Chloratome. Diese katalysieren ebenfalls den Ozonzerfall in der Atmosphäre.
Chlorperoxid
Chlorperoxid (ClOO) ist ein kurzlebiges Isomer von Chlordioxid. Es kann
durch Umlagerung aus Chlordioxid nach seiner Aufspaltung durch Licht oder aus
einem Chlorradikal und Sauerstoff entstehen und hat eine Lebensdauer von nur
0,3–0,4 Nanosekunden.
Auch
Dichlordioxid wird manchmal als Chlorperoxid bezeichnet, wegen der kurzen
Lebensdauer von ClOO besteht dabei aber kaum eine Verwechslungsgefahr.
Dichlortrioxid
Dichlortrioxid (Cl2O3) ist bei −78 °C ein metastabiler, dunkelbrauner Festkörper, der sich bei −45° langsam, bei etwa 0 °C explosiv zu Cl2 und O2 zersetzt. Dichlortrioxid kann als Chlorchlorat (Cl–OClO2) betrachtet werden. Dichlortrioxid besitzt eine Molmasse von 118,91 g/mol. Es kann durch Tieftemperaturphotolyse aus Chlordioxid entstehen:
Dichlortetraoxid
Dichlortetraoxid (Cl2O4) kann als Chlorperchlorat (Cl–OClO3, Chlor(I,VII)-oxid) angesehen werden. Es lässt sich fotochemisch aus Chlordioxid sowie durch Chlorierung von Perchloraten mit Chlorfluorsulfonat darstellen.
Chlortrioxid
Chlortrioxid (ClO3) ist pyramidal aufgebaut. Durch Bestrahlung spaltet es Sauerstoffatome ab.
Chlortetraoxid
Chlortetraoxid (ClO4) ist ein Radikal. Es existiert nur als Reaktionszwischenprodukt und wird auch bei der Thermolyse von Cl2O6 gebildet.
Dichlorhexaoxid
Dichlorhexaoxid (Cl2O6) ist eine schwarzrote, ölige Flüssigkeit mit einer Dichte von 2,02 g/ml und einer Molmasse von 166,91 g/mol. Sie gefriert bei 3,5 °C und siedet bei 203 °C. Es ist ein starkes Oxidationsmittel und reagiert unter Explosion mit vielen reduzierend wirkenden Stoffen. Als Gas und Flüssigkeit liegt es als kovalentes Chlorylperchlorat vor (Chlor(V,VII)-oxid, gemischtes Anhydrid aus Chlor- und Perchlorsäure), als Feststoff mit isolierten ClO2+ und ClO4−-Ionen.
Man kann es darstellen, indem man Chlordioxid mit sauerstoffverdünntem Ozon oxidiert:
Bei Reaktion mit Wasser entstehen Perchlorsäure und Chlorsäure, mit Ozon langsam Dichlorheptaoxid:
Dichlorheptaoxid
Dichlorheptaoxid (Cl2O7) ist ein farbloses Öl mit einer Dichte von 1,86 g/ml. Es gefriert bei −92 °C, siedet bei 82 °C und besitzt eine Molmasse von 182,91 g/mol. Das Molekül besitzt keine Spiegelebene, die beiden ClO3-Gruppen sind gegeneinander um 15 Grad verdreht. Dichlorheptaoxid ist zwar explosiv, aber dennoch das beständigste Chloroxid.
Dichlorheptaoxid ist das Anhydrid der Perchlorsäure; dementsprechend kann es durch Dehydratisierung von Perchlorsäure mit Phosphorpentoxid mit einer sich anschließenden Vakuum-Destillation dargestellt werden:


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 03.02. 2022