Kettenpolymerisation
Kettenpolymerisation (engl. nach IUPAC chain polymerization, im deutschen Sprachraum oft und nicht IUPAC-konform Polymerisation) ist eine Sammelbezeichnung chemischer Reaktionen, bei denen sich fortlaufend gleiche oder unterschiedliche Monomere an ein wachsendes Polymer angliedern. Dabei findet weder eine Abspaltung von Nebenprodukten, noch eine Wanderung von Molekülgruppen innerhalb der Reaktanden statt. Keine Kettenpolymerisationen sind damit Polykondensationen und Polyadditionen.
Kettenpolymerisationen lassen sich nach ihren aktiven Zentren in radikalische, kationische, anionische und koordinative Kettenpolymerisationen unterteilen. Bei den Monomeren handelt es sich meist um ungesättigte, organische Verbindungen.
Mechanismen
Radikalische Kettenpolymerisation
Die radikalische Polymerisation umfasst im Wesentlichen drei Teilschritte:
- Startreaktion, bei der das aktive Zentrum gebildet wird.
- Wachstumsreaktion, bei der die makromolekulare Kette in einer Kettenreaktion wächst (wiederholte Anlagerung der Monomere), und
- Abbruchreaktion, bei der das Wachstum der Kette durch Disproportionierungsreaktionen oder Kombinierung irreversibel beendet wird.
Mechanismus
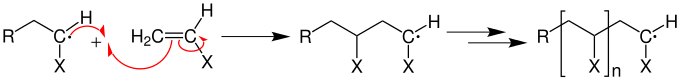
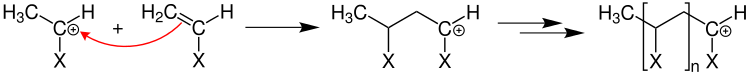
Zum Kettenstart bricht ein Radikal die Mehrfachbindung (beispielsweise eine C=C-Doppelbindung einer Vinylgruppe) auf und erzeugt ein wachstumsfähiges Primärradikal:
An das Primärradikal lagern sich nun in einer Wachstumsreaktion mit geringer Aktivierungsenergie ständig Monomere an.
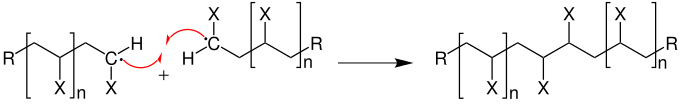
Durch das Zusammentreffen zweier Radikale, also durch Kombination, wird ein Kettenabbruch hervorgerufen.
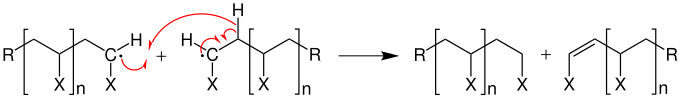
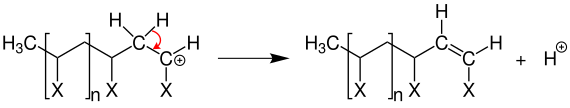
Des Weiteren kann ein Kettenabbruch durch Disproportionierung herbeigeführt werden.
Daneben kann eine gewisse Kontrolle über die molare Masse erreicht werden, indem man der Polymerisation Kettenüberträger hinzufügt.
Kinetik der radikalischen Kettenpolymerisation
Für jede der Teilreaktionen der radikalischen Polymerisation lassen sich Gleichungen für die Reaktionsgeschwindigkeiten formulieren. Die Kenntnis dieser Zusammenhänge ermöglicht es, den mittleren Polymerisationsgrad eines entstehenden Polymers zu steuern, sowie einige bei der Polymerisation auftretende Effekte zu deuten.
Initiation
Die Geschwindigkeit
der Initiation hängt von der Konzentration des Initiators
und von dem entsprechenden Geschwindigkeitskoeffizienten
ab:
Der Initiator-Zerfall liefert aber nicht unbedingt vollständig wirksame Radikale R*, da
manche davon nicht einen Kettenstart verursachen, sondern anderweitig
abreagieren oder rekombinieren. Dementsprechend wird ein Faktor
eingeführt, der die Wirksamkeit des Initiatorzerfalls für den Kettenstart
wiedergibt:
Kettenwachstum
Die Geschwindigkeit
des Kettenwachstums, also des Monomerverbrauchs, ist abhängig von der
Monomerkonzentration
,
der Konzentration der Polymerradikale
und dem entsprechenden Geschwindigkeitskoeffizienten
:
Rekombination
Die Geschwindigkeit
der Rekombination, also des Verbrauchs an Polymerradikalen P*, hängt quadratisch
von deren Konzentration
ab und natürlich vom Koeffizienten
:
Übertragung
Die Geschwindigkeit der Übertragung ,
hängt von der Konzentration des Überträgers
,
der Konzentration der Polymerradikale
und dem Koeffizienten
ab:
Wurzel-I-Gesetz
Aus den gegebenen Geschwindigkeitsgesetzen kann man eine Formel für die Wachstumsgeschwindigkeit herleiten. Diese gilt nur bei mittleren Umsätzen, gibt aber dann im Grunde die Bruttoreaktionsgeschwindigkeit an:
Mayo-Gleichung
Ebenso kann man das Zahlenmittel des Polymerisationsgrades
bestimmen. Es ergibt sich aus dem Verhältnis der Wachstumsgeschwindigkeit zu den
Geschwindigkeiten aller Reaktionen, bei denen das Wachstum abbricht:
Mayo hat daraus eine Formel abgeleitet, mit der man entweder die
Übertragungskonstante
für ein Gemisch von Monomer und Überträger berechnen kann, oder den mittleren
Polymerisationsgrad des entstehenden Polymers, wenn man konkrete Mengen Monomer
und Überträger mischt:
Darin ist
das Zahlenmittel des Polymerisationsgrades bei Abwesenheit eines Überträgers.
Polymerisationsverlauf
Der Reaktionsablauf der radikalischen Polymerisation sieht wie folgt aus:
- Umsatz < 0,01 %: Initiation – Nicht stationärer Verlauf
- Es entstehen zunehmend Initiator-Radikale, Primärradikale und wenige oligomere Radikale. Die Gesamtreaktionsgeschwindigkeit steigt rasant, der durchschnittliche Polymerisationsgrad ist gering.
- Umsatz 0,01 bis 5 %: Ideal stationärer Reaktionsverlauf
- Bei so geringem Umsatz kann die Monomerkonzentration als konstant betrachtet werden, ebenso die Anzahl vorhandener Radikale, die Gesamtreaktionsgeschwindigkeit bleibt konstant, während der Polymerisationsgrad steigt. Es entstehen erste Makroradikale. Die Polymerisationsgradverteilung ist relativ eng.
- Umsatz 5 bis 20 %: Ende des stationären Reaktionsverlaufes
- Die Monomerkonzentration nimmt durch den Verbrauch stark ab, wodurch die Reaktionsgeschwindigkeit abnimmt. Es sind nun viele Makroradikale vorhanden und Abbruch-Reaktionen finden statt.
- Umsatz 20 bis 60 %: Gel- oder Trommsdorff-Norrish-Effekt
- Die Polymerisation unterliegt einer Selbstbeschleunigung. Es liegen nun sehr große Polymerradikale vor, die wegen ihrer Größe diffusionsgehindert sind. Das hat zur Folge, dass immer weniger Abbruchreaktionen stattfinden, während die Monomere noch mobil genug sind, um die Reaktion am Leben zu erhalten, und der Initiator weiterhin zerfällt und neue Radikale bildet. In dieser Phase nimmt der Polymerisationsgrad stark zu, und die Polymerisationsgradverteilung wird sehr breit.
- Umsatz 60 % bis max.: Glas-Effekt
- Die Polymermoleküle und Polymerradikale sind mittlerweile so groß und unbeweglich, dass das Reaktionsgemisch langsam erstarrt (deswegen „Glas“). Die übrigen Monomere sind im Reaktionsgemisch zunehmend unbeweglich, weswegen die Polymerisation immer langsamer fortschreitet. Ein vollständiger Umsatz wird i.d.R. nicht erreicht.
Aktuelle Trends
Seit wenigen Jahren ist es möglich, die Abbruchreaktionen der radikalischen Polymerisation zu kontrollieren. Mit den Techniken der Controlled Free Radical Polymerization (LFRP) gelingt es, Polymere mit enger Molmassenverteilung durch Zusatz eines 'Kontrollreagenz' zu synthetisieren. Je nach Verwendung des Kontrollreagenzes unterscheidet man bisher zwischen Atom Transfer Radical Polymerization (ATRP), Nitroxide Mediated Polymerization (NMP) und Kettentransfermethoden wie dem Reversible Addition-Fragmentation Chain Transfer-Prozess (RAFT). Gemeinsames Grundprinzip dieser Methoden ist es, zu jedem Zeitpunkt nur eine sehr geringe Anzahl reaktiver Kettenenden zu haben, wodurch die Radikalrekombination als Abbruchschritt stark behindert wird.
Kationische Kettenpolymerisation
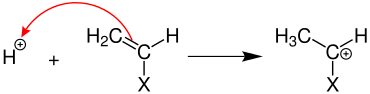
Als Starter fungiert hier beispielsweise eine Säure wie Fluorborsäure, welche in der Startreaktion eine Monomereinheit an der Doppelbindung protoniert.
Bei der Wachstumsreaktion wird das aus der Startreaktion resultierende Kation an ein weiteres Monomer addiert, wobei wiederum ein Kation entsteht.
Eine Abbruchreaktion, wie bei der radikalischen Polymerisation, tritt nicht auf. Allerdings kann durch eine Eliminierungsreaktion ein Proton auf eine neue Monomereinheit übertragen werden.
Somit wird das Wachsen der Kette abgebrochen und ein Proton steht für eine weitere Startreaktion zur Verfügung.
Anionische Polymerisation
Hier stellt die wachsende Kette ein Anion dar, gestartet wird eine solche Reaktion durch Lithiumorganyle oder Grignard-Verbindungen. Häufig kann dabei keine Übertragungs- oder Abbruchreaktion formuliert werden, man spricht dann von einer lebenden Polymerisation. Dadurch können häufig Polymere mit sehr einheitlicher Kettenlänge (Polydispersität nahe eins) gewonnen werden. Anionische Polymerisationsreaktionen sind im Allgemeinen empfindlich gegen geringste Wasserspuren und erfordern daher sehr gründlich absolutierte Ausgangsstoffe.
Koordinative Kettenpolymerisation
Die Katalysatoren sind Übergangsmetallverbindungen, deren Struktur so zu charakterisieren ist, dass ein Zentralatom (das Metall-Ion) derart von Liganden umgeben ist, dass ein Monomer und die Polymerkette daran anlagern (koordinieren) können. Das Prinzip beruht auf einer Aktivierung der Monomere aufgrund der Wechselwirkung des Monomers mit dem Metall. Die Doppelbindung im Monomer wird hierdurch geschwächt und die Anlagerung eines zweiten Monomers initiiert. Zur Stabilisierung der so entstandenen Komplexverbindung schiebt sich das Monomer in die bereits vorhandene Polymerkette ein und ein weiteres Monomer wird angelagert usw. Die Polymerisationsreaktion wird so in die Wege geleitet. Das Verfahren wird auch Insertionspolymerisation genannt.
Der Vorteil der Koordinationspolymerisation liegt darin, dass je nach Wahl von Katalysator und Monomeren die Taktizität des entstehenden Polymers gesteuert werden kann, die wesentlichen Einfluss auf die Polymereigenschaft haben kann.
Es gibt verschiedene Arten von Koordinationspolymerisationen mit unterschiedlichen Mechanismen. Die wichtigste ist die nach ihren Entdeckern benannte Ziegler-Natta-Polymerisation, die es erlaubt, bei niedrigen Temperaturen und niedrigen Drücken zum Beispiel Ethen zu linearem Polyethylen hoher Dichte (PE-HD) umzusetzen. Von großer Bedeutung ist zudem die Polymerisation mit Metallocen-Katalysatoren.
Speziellere Arten der Koordinationspolymerisation wie die ringöffnende Metathesepolymerisation (Ring-Opening Metathesis Polymerization, ROMP) finden ihre Anwendung bei der Herstellung von Spezialpolymeren, die mittels Ringöffnung und Verknüpfung cyclischer Monomere durch Übergangsmetallkatalysatoren produziert werden.
Copolymerisation
Im Gegensatz zur einfachen Homopolymerisation, bei der nur eine einzige Monomerart zum Einsatz kommt, werden bei der Copolymerisation verschiedene Monomere gleichzeitig oder nacheinander zur Reaktion gebracht. Das Produkt der Copolymerisation ist ein Copolymer, das unterschiedliche Monomerarten in einem Molekül besitzt. Je nach der Verteilung der verschiedenen Monomerarten im Polymer unterscheidet man zwischen statistischen, alternierenden, Block- und Pfropf-Copolymeren.
Technische Verfahren
- Substanzpolymerisation (auch Massen- oder Blockpolymerisation genannt): Monomer reagiert mit Initiator in reiner Form ohne Lösemittel
- Lösungspolymerisation: Monomer und Polymer in Lösungsmittel gelöst
- Fällungspolymerisation: Monomer in Lösungsmittel gelöst, Polymer fällt aus
- Emulsionspolymerisation: Monomer durch Emulgator in Wasser gelöst, Polymer fällt aus
- Suspensionspolymerisation: Monomer durch Rühren und Stabilisatoren in Wasser suspendiert (kleine Tropfen), Polymer fällt aus
- Gasphasenpolymerisation: gasförmiges Monomer hält Polymerkörner in Wirbelbett
- Polymerisation monomolekularer Schichten nach Langmuir-Blodgett


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 17.12. 2025