
Spektroskopie
Die Wissenschaft von der Wechselwirkung zwischen Substanz und monochromatischer elektromagnetischer Strahlung.
Sie hat die Aufgabe, sowohl die in einer elektromagnetischen Strahlung (Spektrum, elektromagnetisches)
enthaltenen Frequenzen oder
Wellenlängen
als auch die auf diese entfallenden Intensitäten
zu ermitteln und die Ergebnisse zu interpretieren. Die hierfür benutzten Geräte nennt man Spektralapparate.
Die Messung der Wellenlänge kann direkt oder indirekt erfolgen. Die direkte Messung beruht auf der Wellenlängenabhängigkeit der
Beugungs- und Interferenzerscheinungen,
die indirekte Messung erfolgt
durch Vergleich mit Spektrallinien bekannter Wellenlänge. Sollen diese Ergebnisse dazu dienen,
Rückschlüsse auf die in einer Lichtquelle
oder durchstrahlten Substanz vorhandenen chemischen Elemente
oder Verbindungen oder deren
Zustandsgrößen zu ziehen, so spricht man von angewandter Spektroskopie. (Spektralanalyse).
Spektroskopie elektromagnetischer Strahlung
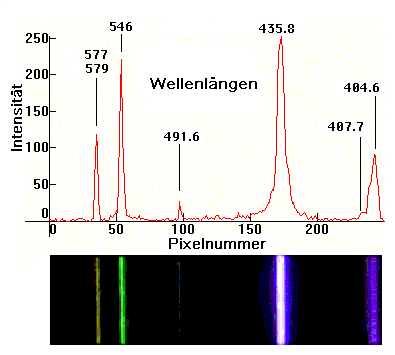
Ein Spektrum im Sinne dieses Artikels ist die Verteilung einer spektralen
Leistungsdichte über einer Energieskala (Frequenz,
Wellenzahl) oder einer
reziproken Energieskala. Der Zusammenhang zwischen der Frequenz
einer elektromagnetischen Welle und der Energie
der Lichtquanten ist dabei gegeben durch
mit der Planck-Konstanten
.
Grundlage zum Verständnis von Spektren ist der Übergang
eines Systems zwischen verschiedenen Energieniveaus
unter Emission oder Absorption von Photonen
oder anderen Teilchen. Mit diesem kann man Absorption
und Emission
von Photonen durch Übergänge zwischen verschiedenen Energieniveaus eines Atoms
beschreiben. Die absorbierte bzw. emittierte Energie
ist dabei durch das anfängliche Energieniveau
und dem End-Energieniveau
festgelegt. In der Quantenmechanik
hat jeder Zustand
ein Energieniveau.
Dabei gilt:
Ist ,
die Differenz also positiv, so handelt es sich in diesem Beispiel um Emission,
bei negativen Vorzeichen, also
dann um Absorption.
Strukturen im Spektrum geben Hinweise darauf, welche Energiebeträge eine Substanz aufnehmen (absorbieren) oder abgeben (emittieren) kann. Diese Beträge entsprechen Energiedifferenzen quantenmechanischer Zustände der Probe. Das Spektrum eines Stoffes hängt insbesondere ab von dessen Konzentrationen, von Auswahlregeln und Besetzungszahlen.
Klassische Spektroskopie
Die Untersuchung der Lichtemission bzw. -absorption von Molekülen und Atomen mit Hilfe von Gitter- und Prismenspektrometern sind die ältesten spektroskopischen Verfahren. Sie werden daher auch als klassische Spektroskopie bezeichnet. Viele der grundlegenden Untersuchungen über den Aufbau des Atoms wurden erst durch die Entwicklung und Anwendung hochauflösender Gitter- und Prismenspektrometer möglich.
Als besondere Gebiete der Spektroskopie sind zu nennen:
Die Vakuumspektroskopie, dasjenige Teilgebiet der Spektroskopie, das sich mit der Untersuchung der Spektren unterhalb 200 nm beschäftigt. Hierfür werden Vakuumspektrographen benutzt, da in diesem Wellenlängenbereich Absorption durch die Bestandteile der atmosphärischen Luft auftritt.
Die Ultraviolettspektroskopie, auch UV-Spektroskopie, sie umfaßt den UV-Bereich von 200 nm bis 400 nm; auch hierfür gibt es besondere Spektralapparate, die Ultraviolettspektrographen.
Die Infrarotspektroskopie, auch IR-Spektroskopie genannt.
Die Raman-Spektroskopie, Raman-Effekt.
Erscheinung das die Streustrahlung, die man beobachtet, wenn Licht einer bestimmten Wellenlänge λ und demnach einer bestimmten
Frequenz γ = c/λ durch Materie gestreut wird
nicht nur diese Frequenz, sondern außerdem eine Reihe anderer Frequenzen γR < γ enthält.
Die Röntgenspektroskopie.
Die Mikrowellenspektroskopie; sie gestattet die Messung der Absorptionslinien von Gasen und Dämpfen, da die Rotationsenergien von Gasen und
Dampfmolekülen solche Werte annehmen, daß ihre
Rotationsspektren in den Bereich der elektrischen Kurzwellen fallen. So befindet sich z. B. eine Absorptionslinie des H2O-Moleküls bei λ = l, 343 cm
![]() 22 235 MHz.
22 235 MHz.
Mittels der Mikrowellenspektroskopie lassen sich sehr genau viele Moleküldaten ermitteln, wie z. B. Trägheitsmomente, Kernabstände, Kernmomente u. a..
Unter Hochfrequenzspektroskopie versteht man jene auf hochfrequenztechnischen Grundlagen fußenden Verfahren, die die spektrale Erforschung des Gebietes der Hertzschen Wellen (λ = l bis 105 mm) zur Aufgabe haben, z. B. Radioastronomie; die Mikrowellenspektroskopie umfaßt den kurzwelligen Teil dieses Gebietes.
Außerdem kann man nach den zerlegenden Spektralapparaten auch zwischen Prismen-, Beugungs- und Interferenzspektroskopie unterscheiden.
Die Massenspektroskopie hat hinsichtlich der Methoden und Ziele mit der eigentlichen Spektroskopie nichts zu tun.
Spektroskopiearten
Allgemein unterscheidet man zwischen Methoden der Atom- und der Molekülspektroskopie. Die Atomspektroskopie umfasst spektroskopische Verfahren, die auf Emissions-, Absorptions- oder Fluoreszenzvorgängen bei Atomen zurückgehen und zur Bestimmung von chemischen Elementen eingesetzt werden. Die beobachteten Spektren sind im Allgemeinen Linienspektren. Die molekülspektroskopischen Verfahren basieren hingegen auf der Anregung und Auswertung von Rotations-, Schwingungs- und Elektronenzuständen in Molekülen. Durch die Überlagerung von Einzelzuständen werden dabei keine Linienspektren, sondern sogenannte Bandenspektren beobachtet.
Astronomie
Die Absorptionslinien im Sonnenspektrum wurden nach Josef Fraunhofer benannt, der sie 1813 entdeckte. Doch erst 1859 konnten
Gustav Kirchhoff und
Robert Bunsen die Natur dieser Linien als
Fingerabdrücke von Elementen in der Sonnenatmosphäre erklären. In der folgenden Weiterentwicklung der
Spektralanalyse gelang u. a. William Huggins (USA) und Angelo Secchi (Vatikansternwarte) die systematische Untersuchung von Sternspektren und die
temperaturabhängige Klassifizierung der Sterne.
Die Spektralanalyse des Lichts der Sonne und anderer Sterne zeigte, dass die
Himmelskörper aus denselben Elementen bestehen wie die Erde.
Allerdings wurde Helium zuerst durch Spektroskopie des Sonnenlichtes identifiziert. Eine der solaren Spektrallinien konnte jahrzehntelang keiner
bekannten Substanz zugeordnet werden, so dass bis zum Nachweis des irdischen Vorkommens angenommen wurde, auf der Sonne (griech. Helios)
existiere ein unbekanntes Element.

© biancahoegel.de;
Datum der letzten Änderung: Jena, den: 16.08. 2025
