Lithium-Cobalt(III)-oxid
| Sicherheitshinweise | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Kristallstruktur | |
|---|---|
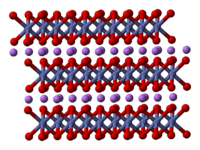 | |
| __ Li+ __ Co3+ __ O2− | |
| Allgemeines | |
| Name | Lithium-Cobalt(III)-oxid |
| Andere Namen |
|
| Verhältnisformel | LiCoO2 |
| CAS-Nummer | 12190-79-3 |
| PubChem | 23670860 |
| Kurzbeschreibung | blaues Pulver |
| Eigenschaften | |
| Molare Masse | 97,88 g/mol |
| Aggregatzustand | fest |
Lithium-Cobalt(III)-oxid ist eine chemische Verbindung von Lithium, Cobaltund Sauerstoff und wird als Material für die positive Elektrode in Lithium-Cobaltdioxid-Akkumulatoren verwendet. Die Brauchbarkeit als Elektrodenmaterial wurde 1980 von einer Forschergruppe um John B. Goodenough an der University of Oxford entdeckt.
In der Struktur liegen die Lithiumatome zwischen zu Oktaedern
geformten Reihen aus Cobalt- und Sauerstoffatomen.
Die Raumgruppe, ausgedrückt in
der Hermann-Mauguin-Symbolik,
ist 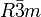 .
.
Lithium-Cobalt-Dioxid ist in Wasser nicht löslich und Kontakt mit Lithium-Cobalt(III)-oxid kann zu Erkrankungen des Herzmuskels führen.
Akkumulatoren basierend auf Lithium-Cobalt-Dioxid neigen bei Überlastung zu thermischen Reaktionen.

Basierend auf einem Artikel in Wikipedia.de

© biancahoegel.de;
Datum der letzten Änderung: Jena, den: 09.04. 2017


