Vinylchlorid
| Sicherheitshinweise | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||
| Toxikologische Daten | 500 mg·kg−1 (LD50, Ratte, oral) | |||||||||||||||||||
Vinylchlorid (Chlorethen, auch Monochlorethen oder – eigentlich veraltet – Monochlorethylen), abgekürzt VC, ist ein farbloses, brennbares, narkotisierendes Gas mit in hoher Konzentration leicht süßlichem, chlorartigen Geruch. Es ist die Grundsubstanz zur Herstellung von Polyvinylchlorid (PVC). Vinylchlorid wurde von Henri Victor Regnault entdeckt.
| Strukturformel | |
|---|---|
| Allgemeines | |
| Name | Vinylchlorid |
| Andere Namen |
|
| Summenformel | C2H3Cl |
| CAS-Nummer | 75-01-4 |
| PubChem | 6338 |
| Kurzbeschreibung | farb- und geruchsloses Gas |
| Eigenschaften | |
| Molare Masse | 62,5 g·mol−1 |
| Aggregatzustand | gasförmig |
| Dichte | 2,86 kg·m−3 (0 °C und 1,013 bar) |
| Schmelzpunkt | −153,7 °C |
| Siedepunkt | −13,4 °C |
| Dampfdruck | 0,33 MPa (20 °C) |
| Löslichkeit |
|
| Dipolmoment | |
| Brechungsindex | 1,3700 (20 °C) |
| Thermodynamische Eigenschaften | |
| ΔHf0 | 37,2 kJ/mol |
Synthese
Bei der Herstellung von Vinylchlorid wird in einem ersten Schritt aus Ethen und Chlor durch so genannte „Direktchlorierung“ 1,2-Dichlorethan erzeugt.
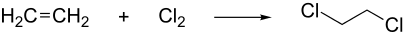 ΔH = −180 kJ/mol
ΔH = −180 kJ/mol
Weit verbreitet ist auch die Darstellung mittels Oxychlorierung von Ethen mit Chlorwasserstoff und Sauerstoff.
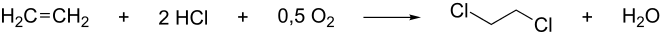 ΔH = −239 kJ/mol
ΔH = −239 kJ/mol
In einem nachgeschalteten Schritt wird das 1,2-Dichlorethan unter Abspaltung von Chlorwasserstoff zu Vinylchlorid umgesetzt.
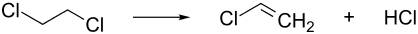 ΔH = +71 kJ/mol
ΔH = +71 kJ/mol
Eine weitere Möglichkeit ist die Addition von Chlorwasserstoff an Ethin.
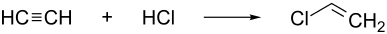 ΔH = −99 kJ/mol
ΔH = −99 kJ/mol
Eigenschaften
Vinylchlorid ist leicht entflammbar (Zündtemperatur 435 °C). Bei einem Volumenanteil von 3,8 bis 31 Prozent in Luft ist es explosiv. Vinylchlorid kondensiert bei −13,9 °C und erstarrt bei −154 °C.
Vinylchlorid polymerisiert bei Einwirkung von Licht, Luft und Wärme zu Polyvinylchlorid. Beim Verbrennen von Vinylchlorid entstehen Chlorwasserstoff und Spuren von Phosgen. Vinylchlorid löst sich fast unbegrenzt in organischen Lösungsmitteln, aber nur wenig in Wasser.
Verwendung
Der Hauptverwendungszweck von Vinylchlorid ist die Herstellung von Polyvinylchlorid (2004 rund 38 Millionen Tonnen). Dies geschieht mittels radikalischer Polymerisation. Früher wurde Vinylchlorid auch unter diversen Namen als Kühlmittel verwendet.
Umwelt
In ihren Air Quality Guidelines for Europe geht die Weltgesundheitsorganisation davon aus, dass die in westeuropäischen Ländern generell vorhandene, durchschnittliche Luftkonzentration zwischen 0,1 und 0,5 μg/m3 liegt. In der Nachbarschaft von Vinylchlorid- und Polyvinylchlorid-Anlagen können die 24-Stunden-Konzentrationen 100 μg/m3 überschreiten. In Entfernungen von über einem Kilometer zur Anlage liegen sie üblicherweise unter 10 μg/m3. VC zersetzt sich an der Luft und hat eine Halbwertszeit von 20 Stunden. Die WHO geht davon aus, dass bei einer lebenslangen Exposition mit 1 μg/m3 das Krebsrisiko bei 1 zu 1 Million liegt.
Sicherheitshinweise
Vinylchlorid wurde lange Zeit lediglich als betäubend und augenreizend eingestuft. Die toxischen Eigenschaften für den Menschen wurden erstmals in den 1960er Jahren erkannt. Erst Anfang der 1970er Jahre wurde das klinische Bild der Vinylchlorid-Krankheit erkannt. Leber, Speiseröhre, und Milz sowie die Durchblutung der Hand, die Handknochen und die Haut sind hiervon betroffen.
Exposition mit Vinylchlorid ist ätiopathologisch als Ursache der idiopathischen Akroosteolyse (Black-Nail-Syndrom) und des Raynaud-Syndroms beschrieben worden.
Des Weiteren wurde es als krebserzeugend eingestuft und kann beispielsweise Hämangioendothelsarkome der Leber verursachen.
Die Grenzwerte für die maximale Vinylchlorid-Konzentration am Arbeitsplatz wurden laufend herabgesetzt: 1966 betrug der MAK-Wert 500 ppm, 1971 100 ppm und 1974 50 ppm. Wegen der inzwischen erwiesenen Karzinogenität kann heute kein MAK-Grenzwert festgelegt werden.
Bei der Handhabung sind als Schutzmaßnahmen Atemschutz und Vollschutz notwendig. Die Lagerung erfolgt in Druckdosen und -zylindern.
Abbau
Thiodiglycolsäure kann als Metabolit von Vinylchlorid im Urin nachgewiesen werden.
Weitere Angaben
Der Luftgrenzwert nach TRGS 900 beträgt bei bestehenden Anlagen zur VC- und PVC-Herstellung 8 mg · m−3 bzw. 3 ml · m−3 (Technische Richtkonzentration) und bei allen übrigen Anlagen 5 mg · m−3 bzw. 2 ml · m−3 (TRK). Vinylchlorid ist als krebserzeugend der Kategorie K1 (Stoffe, die beim Menschen bekanntermaßen krebserzeugend wirken) eingestuft.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 15.06. 2022




