
Überkritisches Wasser
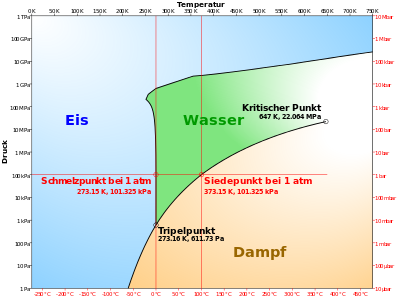
Überkritisches Wasser (auch superkritisches Wasser oder scH2O, von englisch supercritical) ist Wasser in einem fluiden Zustand über seiner kritischen Temperatur und seinem kritischen Druck – also jenseits des kritischen Punktes.
Oberhalb des kritischen Punktes ist eine Unterscheidung, ob ein Stoff flüssig oder gasförmig ist, nicht möglich, er ist dicht wie eine Flüssigkeit, hat aber dieselbe Viskosität wie ein Gas. Um in den überkritischen Zustand zu gelangen, muss das Wasser dazu mindestens eine Temperatur von 374,12 °C und einen Druck von mindestens 221,2 bar – also rund den 221-fachen normalen Luftdruck – haben.
Eigenschaften und Verwendung
Überkritisches Wasser besitzt deutlich andere Eigenschaften als unter Normbedingungen. Es hat die Dichte des normalen Wassers und die Viskosität des Wasserdampfes.
Es wird als Lösungsmittel bei der Zersetzung von Elektroschrott, radioaktiv kontaminierter Erde, vielen organischen Verbindungen und weiteren Problemstoffen verwendet.
In etwa 500 Kohlekraftwerken weltweit wird überkritisches Wasser im Dampfprozess verwendet. Dabei erreicht der Frischdampf Temperaturen von bis zu 580 °C und Drücke von etwa 270 bar und somit den überkritischen Zustand. Kraftwerke mit überkritischen Frischdampftemperaturen von 700 °C und -drücken von 350 bar befinden sich in der Entwicklung. Der Einsatz von überkritischem Wasser in Kernkraftwerken ist noch Gegenstand der Forschung, z.B. Überkritischer Leichtwasserreaktor.
Geschichte
Das Phänomen der überkritischen Fluide ist seit 1822 bekannt. Damals entdeckte Baron Charles Cagniard de la Tour die Existenz einer kritischen Temperatur, oberhalb der die Phasengrenze flüssig/gasförmig einer in einem Druckgefäß eingeschlossenen Flüssigkeit verschwindet. Im Jahr 2005 wurde überkritisches Wasser im Atlantischen Ozean gefunden, wo es aus zwei Hydrothermalquellen austritt.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 07.11. 2015