
Lindemann-Mechanismus
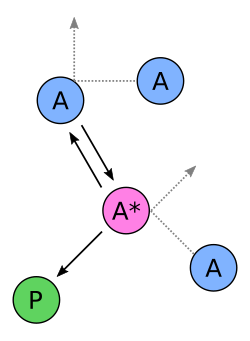
In der Kinetik ist der Lindemann-Mechanismus, der manchmal auch als Lindemann-Hinshelwood-Mechanismus bezeichnet wird, ein schematischer Reaktionsmechanismus für Reaktionen in der Gasphase. Das Konzept wurde 1921 von Frederick Lindemann vorgeschlagen und von Cyril Norman Hinshelwood entwickelt.[1][2] Eine scheinbar unimolekulare Reaktion wird dabei in zwei elementare Schritte zerlegt. Der Lindemann-Mechanismus wird verwendet, um Gasphasenzersetzungs- oder -isomerisierungsreaktionen darzustellen. Die Reaktionsgleichungen von Zersetzungs- oder Isomerisierungsreaktionen lassen häufig vermuten, dass eine unimolekulare Reaktion vorliegen könnte:
Doch der Lindemann-Mechanismus zeigt, dass dem unimolekularen Reaktionsschritt ein bimolekularer Aktivierungsschritt vorausgeht. Für bestimmte Fälle ergibt sich daher eine Reaktion zweiter und nicht, wie zu erwarten wäre,
erster Ordnung:[3] Wechselwirken zwei Moleküle
und
miteinander, so kann es zur Bildung eines
angeregten Moleküls
kommen.[4][5] Das angeregte Molekül kann nun entweder wieder desaktiviert werden, indem es mit
anderen Molekülen
wechselwirkt (dies stellt die Rückreaktion dar),
oder unimolekular und irreversibel zu Produkt
reagieren. Die Geschwindigkeitskonstanten
werden hier mit
,
und
bezeichnet:[4][5]
Findet der unimolekulare Schritt so langsam statt, dass er geschwindigkeitsbestimmend ist, beobachtet man eine Reaktion erster Ordnung.[5]
Geschwindigkeitsgesetz
Die Geschwindigkeit, mit der das Produkt
gebildet wird ergibt sich aus dem
Bodenstein’schen Quasistationaritätsprinzip. Wir nehmen hierbei an, dass die Konzentration des
aktivierten Eduktes (das Intermediat
) in gleicher Geschwindigkeit gebildet
wie verbraucht wird.[6] Diese Annahme vereinfacht die Formulierung der Geschwindigkeitsgleichung der Gesamtreaktion. Die Geschwindigkeitskonstante der Hinreaktion des
ersten Schritts bezeichnen wir mit
, die Rückreaktion mit
. Die Geschwindigkeitskonstante der Hinreaktion des
zweiten Schritts bezeichnen wir mit
.
Die Geschwindigkeit, mit der
gebildet wird, ergibt sich somit
durch folgendes differentielles Geschwindigkeitsgesetz:
(Hinreaktion im ersten Schritt)
wird sowohl bei der Rückreaktion als auch bei der Produktbildung im zweiten Schritt verbraucht. Es ergeben sich folgende differentielle Geschwindigkeitsgesetze:
(Rückreaktion im ersten Schritt)
(Hinreaktion im zweiten Schritt)
Insgesamt betrachtet ergibt sich:
Nach dem Quasistationaritätsprinzip ist die Bildung von
gleich dem Verbrauch von
:
Daher ergibt sich:
Aufgelöst nach :
Das differentielle Geschwindigkeitsgesetz ergibt so für die Gesamtreaktion:[7][6]
Dieses Geschwindigkeitsgesetz ist (noch) keine Reaktion erster Ordnung bezüglich
.[5] Wenn jedoch die Desaktivierung angeregter
-Moleküle
durch die Rückreaktion schneller erfolgt als die unimolekulare Reaktion zum Produkt
,
so kann man
im Nenner vernachlässigen. Fasst man die Konstanten
,
und
zu einer Konstante
zusammen, gilt näherungsweise:
Dies ist ein Geschwindigkeitsgesetz erster Ordnung.[5]
Reaktionsordnung
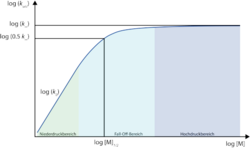
Die Reaktionsordnung einer Reaktion, die annähernd dem Lindemann-Mechanismus folgt, ist druckabhängig. Bei hohem Druck (Hochdruckgrenzwert
für
) handelt es sich um eine
Reaktion erster und bei niedrigem Druck (Niederdruckgrenzwert
für
) um eine Reaktion zweiter Ordnung.
Siehe auch
Einzelnachweise
- ↑ Francesco Di Giacomo: A Short Account of RRKM Theory of Unimolecular Reactions and of Marcus Theory of Electron
Transfer in a Historical Perspective. In: Journal of Chemical Education. Band 92,
Nr. 3. ACS, 10. März 2015, S. 476–481,
doi:
 10.1021/ed5001312.
10.1021/ed5001312.
- ↑ F. A. Lindemann, Svante Arrhenius, Irving Langmuir, N. R. Dhar, J. Perrin, W. C. McC. Lewis: Discussion
on “the radiation theory of chemical action”. In: Transactions of the Faraday Society. Band 17,
1922, S. 598–606,
doi:
 10.1039/TF9221700598.
10.1039/TF9221700598.
- ↑
 "Gas phase decomposition by the Lindemann mechanism" by S. L. Cole and J. W. Wilder.
SIAM Journal on Applied Mathematics, Vol. 51, No. 6 (Dec., 1991), S. 1489–1497.
"Gas phase decomposition by the Lindemann mechanism" by S. L. Cole and J. W. Wilder.
SIAM Journal on Applied Mathematics, Vol. 51, No. 6 (Dec., 1991), S. 1489–1497.
- ↑ Hochspringen nach: a b Gerd Wedler, Hans-Joachim Freund: Lehr- und Arbeitsbuch Physikalische Chemie. Siebte, wesentlich überarbeitete und erweiterte Auflage. Weinheim 2018, ISBN 978-3-527-34611-0, S. 541 f.
- ↑ Hochspringen nach: a b c d e Peter W. Atkins: Physikalische Chemie. 5. Auflage. Weinheim 2013, ISBN 978-3-527-33247-2, S. 860 f.
- ↑ Hochspringen nach: a b Atkins P. and de Paula J., Physical Chemistry (8th ed., W.H. Freeman 2006) S. 820-1, ISBN 0-7167-8759-8.
- ↑ Steinfeld J.I., Francisco J.S. and Hase W.L. Chemical Kinetics and Dynamics (2nd ed., Prentice-Hall 1999), S. 335, ISBN 0-13-737123-3.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 22.01. 2026