γ-Schleife
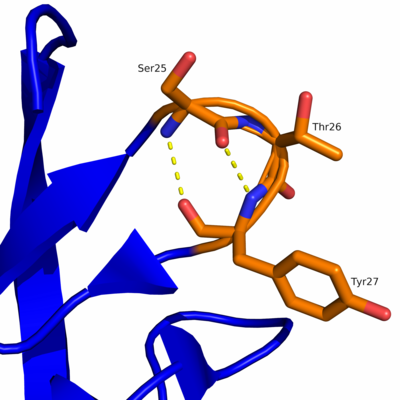
Eine γ-Schleife ist ein Sekundärstrukturelement in Proteinen, das den vollständigen Richtungswechsel einer Polypeptidkette erlaubt. Unter den Schleifenstrukturen in Proteinen bezeichnet die γ-Schleife eine Wechselwirkung zwischen einer Aminosäure mit einer zwei Positionen entfernten Aminosäure, d.h. in γ-Position.
Die γ-Schleife ist in der Lage, zwei antiparallele β-Faltblattstrukturen mithilfe von drei Aminosäureresten zu verbinden. Des Weiteren enthält die γ-Schleife zwei Wasserstoffbrückenbindungen, die sich jeweils zwischen dem ersten und dritten Aminosäurerest befinden. Eine inverse γ-Schleife verhält sich spiegelbildlich zur klassischen γ-Schleife.
Struktur der klassischen γ-Schleife
Die γ-Schleife enthält zwei Wasserstoffbrückenbindungen. Dabei wird eine Wasserstoffbrückenbindung zwischen der Carbonylgruppe (–C=O) des ersten Aminosäurerestes (n) und dem Amidproton (–NH) des dritten Aminosäurerestes (n+2) gebildet, was zur Bildung eines siebengliedrigen Ringes führt. Diese Ringstruktur mit
Torsionswinkeln von
und
wurde in mehreren Studien als stabile Konformation vorgeschlagen. Obwohl diese Wasserstoffbrückenbindung sehr stark gebeugt ist, weist sie eine
normale H…O-Länge auf. Dennoch hat sie einen beträchtlichen Einfluss
auf die Stabilität des gefalteten, siebengliedrigen Ringes (siehe Tabelle 2). Die Faltung des zweiten Aminosäurerestes erlaubt außerdem die Bildung einer
zweiten Wasserstoffbrückenbindung zwischen dem Amidproton des ersten Aminosäurerestes und dem Carbonylsauerstoff des dritten Aminosäurerestes.
Diese Bindung ist fast gerade und weist eine optimale Bindungsstärke auf (siehe Tabelle 2), die mit den Wasserstoffbrückenbindungen der antiparallelen β-Faltblattstruktur
übereinstimmt.
| Sequenz | Aminosäure- rest |
φ in Grad | Ψ in Grad | ω in Grad |
|---|---|---|---|---|
| –L-Ala3– | n | 172 | 128 | −170 |
| n+1 | 68 | −61 | 172 | |
| n+2 | −131 | 162 | — | |
| –Gly3– | n | 171 | 125 | −170 |
| n+1 | 70 | −61 | 172 | |
| n+2 | −129 | 165 | — |
| Eigenschaften | N1H1…O3C3 | N3H3…O1C1 |
|---|---|---|
| H…O-Länge in Å | 1,82 | 1,78 |
| Gesamtenergie in kcal/mol | −5,5 | −4,5 |
| NHO-Winkel in Grad | 166 | 138 |
| HOC-Winkel in Grad | 166 | 102 |
Inverse γ-Schleife
Die inverse γ-Schleife weist verschiedene Torsionswinkel auf und hängt mit der klassischen γ-Schleife dahingehend zusammen, dass durch
Vorzeichenumkehr der
- und
-Winkel
die jeweiligen Backbone-Konformationen sich spiegelbildlich
zueinander verhalten. Die Mittelwerte für die Torsionswinkel der inversen γ-Schleife liegen bei
und
. Ein Beispiel für eine inverse γ-Schleife ist im Enzym
Proteinase A
von S. griseus an den Positionen 113–115 (Ala-Ala-Asp) zu erkennen.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 23.07. 2023
