Kompressibilitätsfaktor
Der Kompressibilitätsfaktor (Formelzeichen: z oder Z), auch Kompressions- oder Realgasfaktor, nicht zu verwechseln mit der Kompressibilität, ist ein Begriff der Thermodynamik und dient zur Beschreibung der Abweichung eines realen Gases von einem idealen Verhalten.
Der Kompressibilitätsfaktor wird häufig verwendet, um die Zustandsgleichung realer Gase in der dimensionslosen Darstellung zu entwickeln.
Beschreibung
Der Realgasfaktor wird als zusätzlicher Faktor in die Thermische Zustandsgleichung Idealer Gase eingefügt, um das Verhalten realer Gase zu beschreiben:
Er ist damit definiert als:
oder auch:
Hierbei stehen die einzelnen Formelzeichen für folgende Größen:
- p – Druck
- V – Volumen
- R – universelle Gaskonstante
- T – absolute Temperatur
- n – Stoffmenge
- v – spezifisches Volumen
– spezifische Gaskonstante
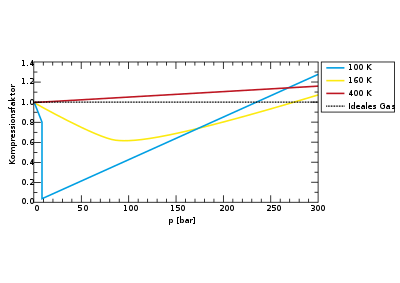
Nur bei geringem Druck und hohen Temperaturen sowie bei einem Volumen, das gegen unendlich strebt, verhalten sich reale Gase annähernd ideal, also entsprechend der Zustandsgleichung idealer Gase mit einem Kompressibilitätsfaktor von Eins. Bei höheren Drücken weichen Gase zum Teil erheblich vom idealen Verhalten ab, da sich sowohl Anziehungs- als auch Abstoßungskräfte zwischen den Teilchen bemerkbar machen. Daher ist der Kompressionsfaktor vom Druck und der Temperatur des Gases abhängig (das molare Volumen wiederum ist allein von der Temperatur abhängig). Ein reales Gas ist bei hohem Druck generell schwerer komprimierbar als ein ideales Gas, was einem Kompressibilitätsfaktor größer Eins gleichkommt. Vorher wird jedoch bei einer Drucksteigerung zunächst ein Minimum durchlaufen (vgl. Abbildung).
Am kritischen Punkt des Gases spricht man zudem vom kritischen Kompressibilitätsfaktor oder kritischen Koeffizienten (siehe Van-der-Waals-Gleichung).
Praktisch technische Anwendungen
Überschlägig (ideal gerechnet, also unter Annahme von idealem Verhalten des Gases) enthält eine Gasflasche (bei Umgebungstemperatur) mit unter Druck stehendem Gas (permanentes Gas, das sich nicht verflüssigt hat) eine Gasmenge, die dem Innenvolumen der Flasche mal dem Druck des Inhalts entspricht.
Die übliche 50 Liter große Gasflasche technischer Gase ist mit 200 bar gefüllt und enthält 50 x 200 = 10.000 Liter = 10 (Norm-)Kubikmeter Gas, wenn es – entnommen – sich auf Normaldruck von etwa 1 bar entspannt.
Tatsächlich weicht die Liefermenge und Ergiebigkeit je nach Gassorte und Druck jedoch deutlich davon ab. Bedeutsam ist das zum Planen der Gasvorrats für einen Tauchgangs oder bei Füllen vieler oder großer Ballons mit Helium, um einen bestimmten Auftrieb zu erreichen.
Taucher kalkulieren mit folgenden Dichten und Korrekturen:
Luft 1 bar 1,168 kg/m3 0 %
Luft 100 bar 117,8 kg/m3 -1,8 %
Luft 200 bar 226,6 kg/m3 +3,1 %
Luft 300 bar 316,3 kg/m3 +10,7 % Korrekturwert = Nötiger Zuschlag zur nominell mitzunehmenden Gasmenge um die gewünschte Ergiebigkeit zu erreichen.
Demnach lässt sich Luft bei Drucken oberhalb etwa 150 bar zunehmend weniger effizient als ideal verdichten.
Gaslieferanten geben in Katalogen die Ergiebigkeit von Gasflaschen als Gasmengen in Normkubikmetern an:
50 L x 200 bar Helium 9,1 m3 Sauerstoff 10,6 m3 Stickstoff 9,6 m3 Wasserstoff 8,9 m3
50 L x 300 bar Helium 13,2 m3 Sauerstoff 15,2 m3 Stickstoff 13,2 m3 Wasserstoff 12,6 m3
Siehe auch


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 13.03. 2021