Alkenmetathese
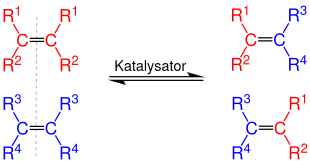
Die Alkenmetathese (auch Olefinmetathese; von griech. Meta: Wechsel und Thesis: Position) ist eine chemische Reaktion, bei der formal die Alkylidengruppen (im Reaktionsschema farbig) zwischen Alkenen ausgetauscht werden, wobei statistisch verteilte Produktgemische entstehen. Die Alkenmetathese ist eine wichtige Reaktion in der organischen Synthesechemie und der Petrochemie.
Geschichte
Erste Beobachtungen
R. L. Banks und G. C. Bailey von der Phillips Petroleum Company entdeckten 1964, dass Propen an heterogenen Kontakten mit Wolfram und Molybdän als Katalysator zu Ethen und Buten umgesetzt wird und nannten die Reaktion Olefin-Disproportionierung.[1] Drei Jahre später wurde dann ein homogenes Katalysatorsystem bestehend aus Wolframhexachlorid und Ethyl-Dimethyl-aluminium in Ethanol/Benzol von der Goodyear Tire & Rubber Company entwickelt und das Verfahren als Olefinmetathese bezeichnet.[2]
Seit Anfang der 1970er Jahre hielt die Alkenmetathese als Forschungsgebiet über industrielle Prozesse hinaus Einzug in die akademische organisch-chemische Forschung.[3]
Es wurden neue Katalysatorsysteme entwickelt.[4][5][6] Jedoch wurde nur von wenigen erfolgreichen Olefinmetathesen an funktionalisierten Substraten bis in die 1980er Jahre berichtet.[7][8] Da die Katalysatoren immer noch auf der Kombination von stark Lewis-sauren Übergangsmetallhalogeniden und metallorganischen Verbindungen beruhten, war die Toleranz gegenüber funktionellen Gruppen umgekehrt sehr gering.
Systematische Untersuchungen durch Chauvin, Schrock und Grubbs
Erstmals detailliert beschrieben wurde die Olefinmetathese 1970 von dem französischen Chemiker Yves Chauvin (1930–2015). Sein Vorschlag zum Mechanismus der Reaktion hat bis heute Gültigkeit. Im Jahre 1990 publizierte Richard R. Schrock einen definierten und in der Alkenmetathese hochreaktiven Katalysator auf der Basis von Molybdän. Dieser ist sehr empfindlich gegenüber Luftsauerstoff und Wasser und toleriert nur wenige ungeschützte funktionelle Gruppen, was seine Anwendung als Synthesereagenz deutlich reduziert.[9][10][11][12]
Zwei Jahre später publizierte Robert H. Grubbs ebenfalls einen definierten Katalysator auf der Basis von Ruthenium. Dieser Katalysator und seine späteren Weiterentwicklungen erwiesen sich ebenfalls als hochreaktiv in der Metathesereaktion, waren allerdings sehr viel beständiger Sauerstoff und Wasser gegenüber.
Alle drei Chemiker, Chauvin, Schrock und Grubbs erhielten 2005 für ihre Erkenntnisse und die großen Fortschritte in der Entwicklung der Metathese den Nobelpreis für Chemie.
Neben den Erfolgen in der Forschung suchte die Industrie nach weiteren Anwendungen für die Olefinmetathese. Ende der 1980 wurden Erfolge erzielt mit der Synthese neuer Polymere mit Hilfe der ADMET (Acyclic Dien Metathesis).[13]
Reaktionsmechanismus
Die allgemeine Reaktionsgleichung in abstrakter Form lautet:
Die Reaktion und die Zusammensetzung des entstehenden Produktgemisches kann durch die Wahl der Reaktionsbedingungen, etwa der Zugabe von Ethylen im Überschuss oder durch Entfernen einer Reaktionskomponente aus dem Produktgemisch, in eine bestimmte Richtung gelenkt werden.
Den Ausgangspunkt des Reaktionsmechanismus bildet ein Metall-Carben-Komplex, der mit einem weiteren Alken einen Metall-Cyclobutankomplex bildet und eine zentrale Rolle im Katalysezyklus spielt. Aus dem Metall-Cyclobutankomplex erfolgt die Elimination der statistisch verteilten Olefinprodukte und eines Metall-Carben-Komplexes.
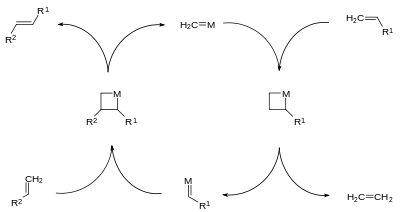
Reaktionsbedingungen
Die Reaktionsbedingungen sind bei modernen Katalysatoren sehr mild. Während der heterogene WO3/SiO2-Kontakt noch Temperaturen von über 300 °C erforderte, sind sowohl der heterogene Re2O7/Al2O3-Kontakt als auch die Grubbs-Katalysatoren schon bei Raumtemperatur aktiv.
Katalysatoren
Die eingesetzten homogenen Systeme bestehen häufig aus drei Komponenten:
- einem Metallsalz oder einem metallorganischen Komplex
- einem Co-Katalysator
- einem Aktivator.
Als katalytisch besonders wirksam haben sich Salze und Komplexe des Molybdän, Rhenium und Wolfram erwiesen. Als Co-Katalysator dienen meist metallorganische Komplexe von Hauptgruppenelementen, besonders von Zinn und Aluminium. Als Aktivatoren in solchen Systemen haben sauerstoffhaltige Verbindungen wie Alkohole oder Ether Anwendung gefunden.
Homogene Katalysatoren
- WCl6
- CH3Re(CO)5
- Schrock-Carbene
- Grubbs-Katalysatoren
Co-Katalysatoren
- Aluminiumalkyle
- Aluminiumalkylchloride
- Zinnalkyle
Aktivatoren
- Ethanol
- Diethylether
- Sauerstoff
Heterogene Katalysatoren
- WO3 auf SiO2
- Re2O7 auf Al2O3
Katalysatorgifte
Als Katalysatorgifte treten vor allem Verunreinigungen des Olefins, wie Wasserspuren und Schwefelwasserstoff, auf. Auch Olefine mit konjugierten Doppelbindungen können homogene Katalysatoren effektiv deaktivieren. Heterogene Katalysatoren können durch polymere Reaktionsprodukte blockiert werden.
Substrate
Fast alle Olefine mit isolierten Doppelbindungen können in der Metathese eingesetzt werden. Olefine mit funktionellen Gruppen können eingesetzt werden, wobei gegebenenfalls vorhandene (Hetero-)Doppelbindungen der funktionellen Gruppe nicht in Konjugation zur Doppelbindung stehen dürfen.
Die Alkenmetathese von Cycloalkenen führt meist zu ungesättigten Polymeren.
Anwendung
Anwendung in der Synthese
Es werden die folgenden Metathese-Reaktionen unterschieden:
- Alken-Kreuz-Metathese
- Ringschluss-Metathese (Ring-closing metathesis, RCM)[14]
- Enin-Metathese (EM)
- Ringöffnende Metathese (ring opening metathesis, ROM)
- Ringöffnende metathetische Polymerisation (ring opening metathesis polymerisation, ROMP)
- Acyclische Dien-Metathese (acyclic diene metathesis, ADMET)
Bei der Ringschluss-Metathese werden α,ω-terminale Diolefine unter Freisetzung von Ethylen in große, mit anderen Methoden nur schwer zugängliche cyclische Olefine umgesetzt. Durch Ringschluss-Metathese konnten bisher gänzlich unbekannte Heterocyclen erstmals synthetisiert werden.[15][16]
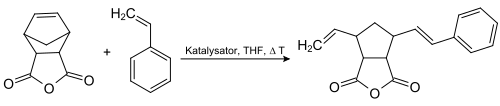
Eine Studie beschrieb die enantioselektive ROM mittels eines Hoveyda-Grubbs-Katalysators:[17]
Bei der ringöffnenden metathetischen Polymerisation (ROMP) reagieren Cycloolefine unter Ringöffnung zu ungesättigten Polymeren. Als Substrat dieser Reaktion dienen vor allem Cycloolefine, die eine gewisse Ringspannung aufweisen, etwa Norbornene oder Cyclopentene, da die treibende Kraft der Reaktion die Verminderung der Ringspannung ist.
Die acyclische Dienmetathese wird genutzt um terminale Diolefine zu Polyenen zu polymerisieren. Die Reaktion wurde 1991 von K. B. Wagener gefunden, der erfolgreich 1,5-Hexadien zu Polybutadien mit 70 % trans-Doppelbindungen und einer mittleren Molmasse von 28000 polymerisierte.
Industrielle Anwendungen
In der Industrie findet die Alkenmetathese hauptsächlich Verwendung in der Petro- und Polymerchemie.
Phillips-Triolefin-Prozess
Beim Triolefin-Prozess wird Propylen in Ethylen und Buten übergeführt. Bislang wurde jedoch nur eine Anlage nach diesem Prozess gebaut, die inzwischen jedoch stillgelegt ist.
Shell-Higher-Olefin-Prozess (SHOP-Prozess)
Beim SHOP-Prozess wird die Olefin-Metathese großtechnisch eingesetzt. Bei den im SHOP-Prozess entstehenden α-Olefinen handelt es sich um Gemische, die destillativ aufgetrennt werden. Die höhermolekulare Fraktion wird isomerisiert und die entstehenden internen Olefine werden mit Ethylen durch Metathese wieder in α-Olefine überführt.
Vestenamer-Verfahren
Beim Vestenamer-Verfahren wird Cycloocten mittels Metathese polymerisiert. Das Verfahren wird als Ring-öffnende-Metathese-Polymerisation (ROMP) bezeichnet. Das entstehende Polyoctenamer ist ein teilkristalliner Kautschuk, der als Verarbeitungshilfe und Weichmacher für andere Kautschuke eingesetzt wird.
Einzelnachweise
- ↑ R. L. Banks, G. C. Bailey: Olefin Disproportionation. A New Catalytic Process In:
Ind. Eng. Chem. Prod. Res. Dev. 3(3), 1964, S. 170–173,
 doi:10.1021/i360011a002.
doi:10.1021/i360011a002.
- ↑ N. Calderon, H. Y. Chen, K. W. Scott: Olefin metathesis - A novel reaction for skeletal transformations of unsaturated hydrocarbons. In: Tetrahedron Letters. 34, 1967, S. 3327–3329.
- ↑ P. B. van Dam, M. C. Mittelmeijer, C. Boelhouver: Metathesis of unsaturated fatty acid esters by a homogeneous
tungsten hexachloride–tetramethyltin catalyst. In: Chem. Commun. 1972, S. 1221–1222,
 doi:10.1039/C39720001221.
doi:10.1039/C39720001221.
- ↑ E. Verkuijen, C. Boelhouver: Formation of cyclohexa-1,4-diene by metathesis of linoleic and linolenic esters.
In: Chem. Commun. 1974, S. 793–794,
 doi:10.1039/C39740000793.
doi:10.1039/C39740000793.
- ↑ R. Nakamura, S. Fukahara, S. Matsumoto, K. Komatsu: Disproportionation of the unsaturated esters. In: Chem. Let. 1976, S. 253–256.
- ↑ H. G. Alt, F. P. D. Sanzo, M. D. Rausch, P. C. Uden: Automated thermal degradation studies on solid σ-organotransition metal complexes: Dimethyl-titanocene, -zirconocene and -hafnocene. In: Organomet. Chem. 107, 1976, S. 257.
- ↑ D. Villemin: Synthese de macrolides par methathese. In: Tetrahedron Letters. 21, 1980, S. 1715–1718.
- ↑ J. Tsuji, S. Hashiguchi: Application of olefin metathesis to organic synthesis. Syntheses of civetone and macrolides. In: Tetrahedron Letters. 21, 1980, S. 2955–2958.
- ↑ R. R. Schrock: Living ring-opening metathesis polymerization catalyzed by well-characterized transition-metal
alkylidene complexes. In: Acc. Chem. Res. 23, 1990, S. 158–165,
 doi:10.1021/ar00173a007.
doi:10.1021/ar00173a007.
- ↑ R. R. Schrock, J. S. Murdzek, G. C. Bazan, J. Robbins, M. Di Mare, M. O´Regan:
Synthesis of molybdenum imido alkylidene complexes and some reactions involving acyclic olefins. In:
J. Am. Chem. Soc. 112, 1990, S. 3875–3886,
 doi:10.1021/ja00166a023.
doi:10.1021/ja00166a023.
- ↑ R. R. Schrock, G. C. Bazan, E. Khosravi, W. J. Feast: Living ring-opening metathesis polymerization
of 2,3-difunctionalized norbornadienes by Mo(:CHBu-tert)(:NC6H3Pr-iso2-2,6)(OBu-tert)2. In:
J. Am. Chem. Soc. 112, 1990, S. 8378–8387,
 doi:10.1021/ja00179a023.
doi:10.1021/ja00179a023.
- ↑ R. R. Schrock, G. C. Bazan, J. H. Oskam: Living ring-opening metathesis polymerization of 2,3-difunctionalized 7-oxanorbornenes
and 7-oxanorbornadienes by Mo(CHCMe2R)(NC6H3-iso-Pr2-2,6)(O-tert-Bu)2 and Mo(CHCMe2R)
(NC6H3-iso-Pr2-2,6)(OCMe2CF3)2. In:
J. Am. Chem. Soc. 113, 1991, S. 6899–6907,
 doi:10.1021/ja00018a028.
doi:10.1021/ja00018a028.
- ↑ M. Lindmar-Hamberg, K. B. Wagener: Acyclic metathesis polymerization: the olefin metathesis reaction of
1,5-hexadiene and 1,9-decadiene. In: Macromolecules. 20, 1987, S. 2949–2951,
 doi:10.1021/ma00177a053.
doi:10.1021/ma00177a053.
- ↑ Katharina Johannes, Martin Watzke, Jürgen Martens: Synthesis of α,β-Unsaturated Caprolactams Starting from Heterocyclic Imines. In: J. Heterocyclic Chem. 47, 2010, S. 697–702.
- ↑ Martin Watzke, Knut Schulz, Katharina Johannes, Pasqual Ulrich, Jürgen Martens: First Synthesis of Bi- and Tricyclic α,β,-Unsaturated δ-Oxacaprolactams from Cyclic Imines via Ring-Closing Metathesis. In: Eur. J. Org. Chem. 2008, S. 3859–3867.
- ↑ Almuth Schwäblein, Jürgen Martens: First Synthesis of α,β-Unsaturated Lactones with High Diversity through the Passerini Reaction and Ring-Closing Metathesis (RCM). In: Eur. J. Org. Chem. 2011, S. 4335–4344.
- ↑ J. J. van Veldhuizen, S. B. Garber, J. S. Kingsbury,
Amir H. Hoveyda: A Recyclable Chiral Ru Catalyst for Enantioselective Olefin Metathesis. Efficient Catalytic Asymmetric Ring-Opening/Cross Metathesis in Air. In:
J. Am. Chem. Soc. 124, 2002, S. 4954–4955,
 doi:10.1021/ja020259c.
doi:10.1021/ja020259c.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 31.03. 2024