Ionenassoziation
Ionenassoziation ist ein Konzept, welches von Niels Bjerrum eingeführt wurde und beschreibt, dass gegenseitig
geladene Ionen aufgrund ihrer elektrostatischen Anziehung in Lösungen sehr nahekommen
und dabei eine Art Einheit bilden, das Bjerrumsche Ionenpaar[1]. Bjerrum charakterisiert zwei Ionen (willkürlich) als assoziiert, wenn sie sich näher als
kommen[2][3]
(mit
den Valenzen der beiden Ionen und
die
Bjerrum-Länge des umgebenden Mediums).
Bjerrum führt für die Assoziation von freien Ionen zu einem Ionenpaar eine Gleichgewichtskonstante
ein:
- An+ + Bm−
AB(n−m)+
In wässrigen Lösungen von Salzen ist stets das Phänomen der Ionenassoziation zu betrachten. Dies gilt umso mehr für Lösungsmittel mit kleinerer dielektrischen Konstante als der von Wasser, da dort die elektrostatische Wechselwirkung stärker ist.
In Lars Onsagers Analysen zum zweiten Wien-Effekt spielen Bjerrumsche Ionenpaare eine Rolle.
Ionenpaar
-
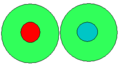 Vollständig solvatisiertes Ionenpaar
Vollständig solvatisiertes Ionenpaar -
 Ionenpaar, mit gemeinsamer Solvationshülle
Ionenpaar, mit gemeinsamer Solvationshülle
Lösungsmittelsepariertes Ionenpaar -
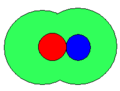 Kontaktionenpaar
Kontaktionenpaar
Ionenpaare aus einem Kation R+ und einem Anion X– können in der organischen Chemie in verschiedenen Formen auftreten:[4]
- intimes oder internes Ionenpaar – auch Kontakt-Ionenpaar. Die durch eine heterolytische Bindungsspaltung entstandenen Ionen R+ und X– bleiben in engem Kontakt miteinander (Ionenassoziation) und sind dabei meist von einer gemeinsamen Solvathülle umgeben.[5]
- lösungsmittelgetrenntes oder externes Ionenpaar. Dabei haben sich ein oder mehrere Lösungsmittel-Moleküle zwischen R+ und X– wobei eine gegenseitige elektrostatischen Anziehung fortbesteht. Durch den größeren Abstand zwischen R+ und X– und die Verteilung der Ladung in den Solvathüllen ist die Anziehungskraft zwischen Kation und Anion jedoch vermindert.
- vollkommen solvatisierte Ionen, die sich praktisch unabhängig voneinander als selbstständige Partikeln bewegen und mehr oder weniger den Diffusionsgesetzen gehorchen.
Beispiele für die Bildung von Ionenpaaren
Ionenpaare bilden sich z. B. im Verlauf einer monomolekularen nucleophilen Substitution, also einer SN1-Reaktion. Auch bei der Beckmann-Umlagerung wird die zwischenzeitliche Bildung von Ionenpaaren diskutiert.[6]
Abgrenzung
Die Anziehung von gelösten Ionen unterschiedlicher Ladung ist ebenfalls in der radialen Verteilungsfunktion sichtbar.
Ein zur Ionenassoziation ähnliches Konzept von gebundenen Ionen ist die Gegenionenkondensation. Gegenionenkondensation beschreibt jedoch nicht wie die Ionenassoziation die Wechselwirkung zweier Ionen (wie die Ionenassoziation), sondern die Wechselwirkung zwischen einem geladenen Stab und seinen Gegenionen.
Einzelnachweise
- ↑ Niels Bjerrum:
 UNTERSUCHUNGEN ÜBER IONENASSOZIATION. I. 1926,.
UNTERSUCHUNGEN ÜBER IONENASSOZIATION. I. 1926,.
- ↑ Niels Bjerrum:
 UNTERSUCHUNGEN ÜBER IONENASSOZIATION. I. 1926.
UNTERSUCHUNGEN ÜBER IONENASSOZIATION. I. 1926.
- ↑ Eintrag zu ion pair. In: 7International Union of Pure and Applied Chemistry7 (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”.
doi:
 10.1351/goldbook.I03231.
10.1351/goldbook.I03231.
- ↑ Ivan Ernest: Bindung, Struktur und Reaktionsmechanismen in der organischen Chemie, Springer-Verlag, 1972, S. 93–96, ISBN 3-211-81060-9.
- ↑ Siegfried Hauptmann: Organische Chemie, 2. durchgesehene Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig, 1985, S. 153, ISBN 3-342-00280-8.
- ↑ Hermann Höver: Reaktionsmechanismen der Organischen Chemie, Verlag Chemie – John Wiley & Sons, 1973, S. 288–289, ISBN 3-527-25442-0.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 03.08. 2025