Raoultsches Gesetz
Das Raoult'sche Gesetz von François Marie Raoult ist eine lineare Näherung für den Dampfdruck flüssiger Gemische. Danach ist für jede Komponente des Gemisches der Partialdruck in der Gasphase gegeben durch das Produkt aus dem Stoffmengenanteil der Komponente und dem Dampfdruck, den der Stoff in Reinform hätte.
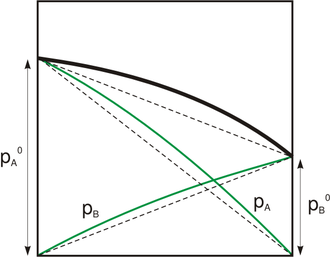
In dem rechts dargestellten Fall ist der Gesamtdruck nur etwas größer als nach dem Raoult'schen Gesetz berechnet. Die meisten realen Gemische zeigen ein stärker nach oben oder unten abweichendes Verhalten.
Haben alle Komponenten bis auf eine (das Lösungsmittel) einen vernachlässigbaren Dampfdruck, so sinkt der Dampfdruck proportional zum gesamten Stoffmengenanteil aller gelösten Stoffe, unabhängig von deren Art. Man nennt den Dampfdruck des Lösungsmittels eine kolligative Eigenschaft.
Formeldarstellung
mit Partialdrücken ,
Dampfdrücken der Reinstoffe
und Stoffmengenanteilen
für
Siehe auch
- Henry-Gesetz (lineare
Näherungen an den Enden der Kurve, für ein kleines
)
Literatur
- Erich Meister: Grundpraktikum Physikalische Chemie. Theorie und Experimente (= UTB. 8329). 2., überarbeitete und erweiterte Auflage. vdf – Hochschul-Verlag an der ETH, Zürich 2012, ISBN 978-3-8252-8489-3.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 30.09. 2020