Protonengradient
Ein Protonengradient ist ein räumlicher oder zeitlicher Unterschied in der Konzentration von Protonen. Es ist der Konzentrationsunterschied an Protonen, genauer an hydratisierten H+-Ionen (H3O+ oder Oxonium), je Strecke oder Zeitspanne an einem bestimmten Punkt im Raum. Da der pH-Wert als Logarithmus der H+-Konzentration definiert ist, werden Protonengradient und pH-Gradient synonym gebraucht.
Protonengradienten können über lange (z. B. zwischen Gewässern unterschiedlichen pH-Werts) oder über kurze Abstände (z. B. an Biomembranen) ausgedehnt sein. Ein sehr abrupter Konzentrationswechsel wird als diskontinuierlicher Gradient bezeichnet.
Eigenschaften
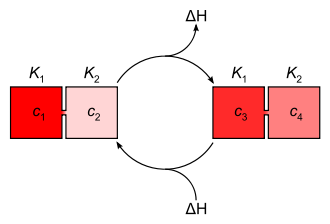
Jedem Konzentrationsgefälle entspricht ein Energiepotential ΔH, das sich aus der Differenz der Lösungs-Enthalpien bzw. der Steilheit eines Proton-Konzentrationsgefälles und im Falle von Protonengradienten auch aus der Neutralisationsenergie ergibt. Beim Konzentrationsausgleich zwischen den Bereichen unterschiedlichen pH-Werts wird Energie frei (exotherme Reaktion), die durch energetische Kopplung genutzt werden kann.
Biochemie
An den Membranen von lebenden Zellen können pH-Gradienten gemessen werden. Nach der Chemiosmotischen Theorie folgt aus einem Protonengradienten ein elektrochemisches Membranpotenzial, das durch chemiosmotische Kopplung genutzt wird.
Protonengradienten werden in der biochemischen Laborpraxis unter anderem bei der SDS-PAGE zur Konzentrierung von Proteinen in einem Polyacrylamidgel, bei der isoelektrischen Fokussierung, bei der Zentrifugation, in der Ionenaustauschchromatographie und in der Affinitätschromatographie verwendet.
Literatur
- Jeremy M. Berg, John L. Tymoczko, Lubert Stryer: Biochemie. 6. Auflage. Elsevier Spektrum Akademischer Verlag, Heidelberg 2007, ISBN 978-3-8274-1800-5
- David L. Nelson, Michael Cox: Lehninger Biochemie. 3. Auflage. Springer, Berlin u.a.O. 2001, ISBN 3-540-41813-X.
- Gerhard Gottschalk: Bacterial Metabolism. 2. Auflage. Springer, New York u.a.O. 1988. ISBN 3-540-96153-4.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 26.06. 2024