
Amphoter
Chemie
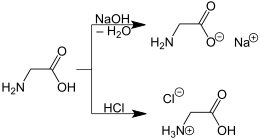
Die einfachste Aminosäure (Glycin,
links) bildet z. B. sowohl mit Natronlauge
als auch mit Salzsäure
ein Salz.
Als Amphoter (von altgriechisch ἀμφοτέρως, amphotéros „auf beiderlei Art“) bezeichnet man in der Chemie einen Stoff, der – je nach Milieu oder Reaktionspartner – in der einen oder anderen Weise reagiert.
- Säure-Base-Amphotere bezeichnet man auch als Ampholyte. Diese können sowohl als Säuren als auch als Basen reagieren. Amphotere Stoffe reagieren somit gegenüber stärkeren Basen wie Säuren und gegenüber stärkeren Säuren wie Basen. Zu den Amphoteren zählen diverse Metalloxide und Metallhydroxide (siehe Tabelle) und die Aminosäuren.
- Als Redox-Amphotere bezeichnet man Stoffe, die sowohl oxidierend als auch reduzierend wirken können. Beispiel: Wasserstoffperoxid
- Amphotere Tenside haben einen kationischen und einen anionischen Teil und besitzen Bedeutung als grenzflächenaktive Stoffe.
Als amphotere Hydroxide bezeichnet man jene Hydroxid-Verbindungen, die sowohl im sauren als auch im alkalischen Medium löslich sind:
| Hydroxid | im Sauren gelöst | im Basischen gelöst |
|---|---|---|
| Kupfer(II)-hydroxid: Cu(OH)2 | Cu2+ | [Cu(OH)4]2− |
| Zinnhydroxid: Sn(OH)2/4 | Sn2+/4+ | [Sn(OH)4/6]2− |
| Antimonhydroxid: Sb(OH)3/5 | Sb3+/5+ | [Sb(OH)4/6]− |
| Aluminiumhydroxid: Al(OH)3 | Al3+ | [Al(OH)4]− |
| Chrom(III)-hydroxid: Cr(OH)3 | Cr3+ | [Cr(OH)6]3− |
| Bleihydroxid: Pb(OH)2 | Pb2+ | [Pb(OH)3]− |
| Zinkhydroxid: Zn(OH)2 | Zn2+ | [Zn(OH)4]2− |
| Berylliumhydroxid: Be(OH)2 | Be2+ | [Be(OH)4]2− |
Physik
In der Festkörperphysik werden beim Dotieren diejenigen Dotanden als amphoter bezeichnet, die sowohl als Akzeptor als auch als Donator wirken können.


© biancahoegel.de;
Datum der letzten Änderung: Jena, den: 11.01. 2022