α-Globin
| Hämoglobin α-Untereinheit | ||
|---|---|---|
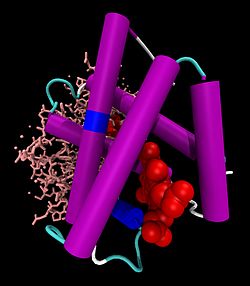
| ||
|
Hb-Dimer: vorne α-Untereinheit als Cartoon-Modell mit Häm (rot, als VDW-Modell), hinten β-Untereinheit als Stäbchen, nach
PDB
| ||
|
Vorhandene Strukturdaten:
| ||
| Masse/Länge Primärstruktur | 16'000 Dalton, 141 Aminosäuren | |
| Kofaktor | Häm | |
| Bezeichner | ||
| Gen-Name(n) |
| |
| Externe IDs | ||
| Vorkommen | ||
| Homologie-Familie |
| |
| Übergeordnetes Taxon | Wirbeltiere | |
α-Globin, alpha-Globin, oder Hämoglobin alpha-Kette ist ein Protein aus der Familie der Globine, dessen 142 Aminosäuren lange Polypeptidkette ein Häm als Cofaktor bindet und das so Teil des Proteinkomplexes von Hämoglobinen in Wirbeltieren ist, die Hämoglobin-Untereinheit alpha (HBA1, HBA2).
Funktion
Das menschliche Hämoglobin-α1-Gencluster befindet sich auf Chromosom 16, umfasst 30 Kilobasen sowie sieben Loci: 5'- ζ - pseudo-ζ - μ - pseudo-α-1 - α-2 - α-1 - θ - 3'. Die codierenden Sequenzen für α-2 (HBA2) und α-1 (HBA1) sind identisch. Diese Gene unterscheiden sich nur wenig in der 5' nicht-translatierten Region sowie den Introns, aber sie unterscheiden sich signifikant in der 3' nicht-translatierten Region. Zwei α-Ketten plus zwei β-Ketten bilden das Hämoglobin A (HbA), welches im normalen Erwachsenenleben ungefähr 97 % des gesamten Hämoglobins umfasst; α-Ketten in Kombination mit delta-Ketten bilden das HbA-2, welches mit HbF („fetal hemoglobin“) die restlichen 3 % des Hämoglobins von Erwachsenen ausmacht. α-Thalassämie resultiert aus der Deletion eines der α-Gene ebenso wie durch Deletion von sowohl HBA2 als auch HBA1; von einigen α-Thalassämien ohne Deletion wurden bereits berichtet.
Interaktion
α-Globin weist mit β-Globin Protein-Protein-Interaktion auf.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 25.03. 2025