Galactose-1-phosphat-Uridyltransferase
| Galactose-1-phosphat-Uridyltransferase | ||
|---|---|---|
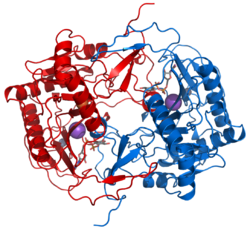
| ||
| Bändermodell der GALT nach
PDB
| ||
|
Vorhandene Strukturdaten: | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 379 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Homodimer | |
| Kofaktor | Zink, Eisen | |
| Bezeichner | ||
| Gen-Name |
| |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie |
| |
| Reaktionsart | Übertragung von UDP | |
| Substrat | UDP-Glucose + α-D-Galactose-1-phosphat | |
| Produkte | UDP-Galactose + α-D-Glucose-1-phosphat | |
| Vorkommen | ||
| Homologie-Familie |
| |
| Übergeordnetes Taxon | Eukaryoten, manche Bakterien | |
Galactose-1-phosphat-Uridyltransferase (GALT) ist ein Enzym. Es bindet die Galactose in Galactose-1-phosphat an UDP; dies ist der zweite Teilschritt beim Abbau von Galactose. GALT kommt in Eukaryoten und wenigen Bakterien vor. Mutationen im GALT-Gen beim Menschen können zu GALT-Mangel und dieser zu klassischer Galaktosämie führen.
Katalysiertes Gleichgewicht
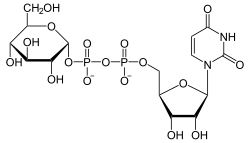 +
+
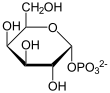
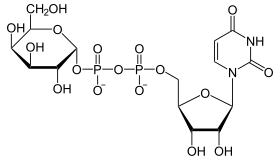 +
+
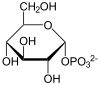
UDP wird von UDP-Glucose auf Galactose übertragen und umgekehrt.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 03.07. 2024